


科目:高中化学 来源: 题型:
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) |
| B、醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小 |
| C、0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| D、常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
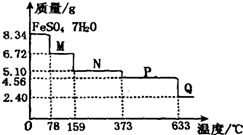 取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )
取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )| A、温度为78℃时固体物质M的化学式为FeSO4?4H2O | ||||
| B、温度为l59℃时固体物质N的化学式为FeSO4?H2O | ||||
C、在隔绝空气条件下,N得到P的化学方程式为:FeSO4
| ||||
| D、固体P隔绝空气加热至650℃,得到一种固体物质Q,同时有三种无色气体生成,Q的化学式为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
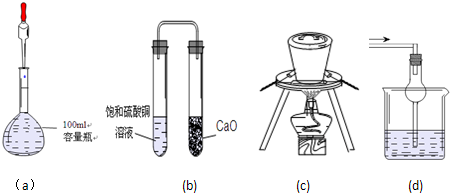
| A、(a) 可用于定容并量取15.00 mL NaOH溶液 |
| B、(b)装置放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| C、(c)可用于高温煅烧石灰石 |
| D、(d)可用于易溶于水的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
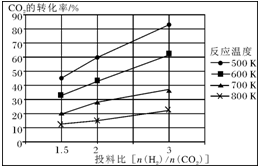 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.| 催化剂 |
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 模拟海水中的 离子浓度/mol?L-1 | Na+ | Mg2+ | Ca2+ | Br- | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.008 | 0.552 | 0.001 |
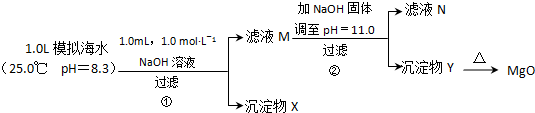
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com