
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
科目:高中化学 来源: 题型:
| A、1.0L 1.0 mol?L-1NaNO3溶液中含有的氧原子数为3NA |
| B、在标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA |
C、 31 g P4 (分子结构如图)中含有的P-P键个数为1.5NA 31 g P4 (分子结构如图)中含有的P-P键个数为1.5NA |
| D、0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、橙花醛可使溴水和酸性高锰酸钾溶液退色 |
| B、橙花醛可以发生银镜反应 |
| C、1mol橙花醛最多可以与3mol氢气发生加成反应 |
| D、橙花醛是丙烯醛的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
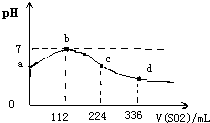 标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A、原H2S溶液的物质的量浓度为0.05mol/L |
| B、氢硫酸的酸性比亚硫酸的酸性强 |
| C、b点水的电离程度比c点水的电离程度大 |
| D、a点对应溶液的导电性比d点强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.560L |
| B、1.12L |
| C、2.24L |
| D、3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1的H2SO4溶液中粒子数为0.15NA |
| B、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| C、1mol CO2分子中共用电子对数为2NA |
| D、23g Na与足量的O2完全反应,失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com