
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2的能量一定高于SO2的能量 |
| B、2molSO2和1molO2的总能量一定高于2molSO3的总能量 |
| C、SO2的能量一定高于SO3的能量 |
| D、因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?H++A2- |
| B、(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-) |
| C、0.0lmol?L-l的H2A溶液pH=2 |
| D、等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、WX2分子中所有原子最外层都已满足8电子结构 |
| B、WX2、ZX2的化学键类型相同 |
| C、原子半径大小顺序为:X<W<Y<Z |
| D、乙醇、乙酸、葡萄糖、油脂中均含W、X两种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) |
| B、醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小 |
| C、0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| D、常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
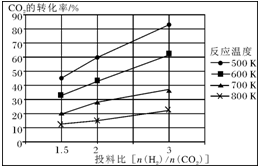 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.| 催化剂 |
| 1 |
| 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com