
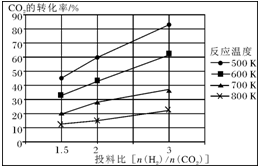
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.| 催化剂 |
| 1 |
| 6 |
| 各个生成物平衡浓度系数次幂之积 |
| 各个反应物平衡浓度系数次幂之积 |
| 各个生成物平衡浓度系数次幂之积 |
| 各个反应物平衡浓度系数次幂之积 |
| c(CH3OCH3)?c(H2O)3 |
| c(CO2)2?c(H2)6 |
| c(CH3OCH3)?c(H2O)3 |
| c(CO2)2?c(H2)6 |
| 催化剂 |
| 0.5x |
| 1-x+3-3x+0.5x+1.5x |
| 1 |
| 6 |
| 0.8 |
| 1 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、X2Y |
| C、XY2 |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
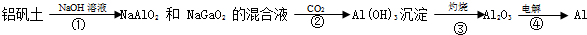
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
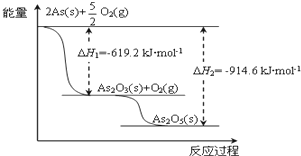 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

 与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:
与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com