
 如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).
如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).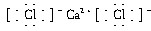 ,故答案为:NH4Cl;
,故答案为:NH4Cl;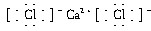 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
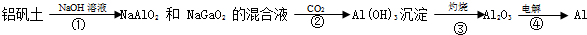
查看答案和解析>>
科目:高中化学 来源: 题型:
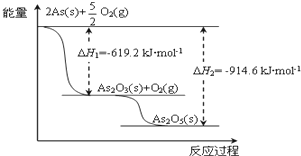 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

 与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:
与丁醛缩合得到的含有六元环的高分子化合物,若已知反应:2CH3OH+HCHO→CH3OCH2OCH3+H2O可以发生.请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
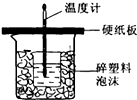 I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.| 实验起始温度(℃) | 实验中止温度(℃) | |
| 实验① | 25.00 | 28.64 |
| 实验② | 25.00 | 28.52 |
| 实验③ | 25.00 | 29.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:
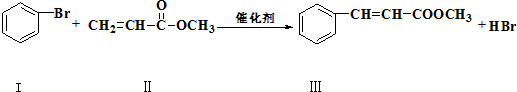
| 浓H2SO4 |
| △ |
| CH3OH |
| 浓H2SO4△ |

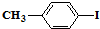 和
和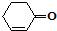 也可以发生类似如图的反应,有机产物的结构简式
也可以发生类似如图的反应,有机产物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
A、等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO
| ||||
| B、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com