
����Ŀ����֪��Ӧ��2SO2��g��+O2��g��2SO3��g����H��0��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ����ʾ��������˵����ȷ���ǣ� �� 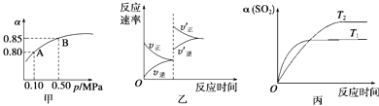
A.��ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L
B.��ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2
C.��ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
D.ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1
���𰸡�C
���������⣺A������������ʼŨ��Ϊ ![]() =0.2mol/L���ɼ�ͼ��֪A��SO2��ת����Ϊ0.8�����ԡ�c��SO2��=0.8��0.2mol/L=0.16mol/L���ʶ��������ƽ��Ũ��Ϊ0.2mol/L��0.16mol/L=0.04mol/L����A����
=0.2mol/L���ɼ�ͼ��֪A��SO2��ת����Ϊ0.8�����ԡ�c��SO2��=0.8��0.2mol/L=0.16mol/L���ʶ��������ƽ��Ũ��Ϊ0.2mol/L��0.16mol/L=0.04mol/L����A����
B���ɼ�ͼ��֪B��SO2��ת����Ϊ0.85�����ԡ�c��SO2��=0.85��0.2mol/L=0.17mol/L����
2SO2��g��+ | O2��g�� | 2SO3��g�� | ||
��ʼ��mol/L���� | 0.2 | 0.1 | 0 | |
�仯��mol/L���� | 0.17 | 0.085 | 0.17 | |
ƽ�⣨mol/L���� | 0.03 | 0.015 | 0.17 |
����B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ0.03��0.015��0.17=6��3��34����B����
C����ƽ�����С�����ݻ�����Ӧ������Ũ�ȶ����������淴Ӧ���ʶ�������ϵѹǿ����ƽ���������С�ķ�Ӧ�ƶ�����ƽ��������Ӧ�ƶ�����V��������V���棩����C��ȷ��
D���ɵ���ƽ���ʱ���֪���¶�ΪT1 �� �ȵ���ƽ�⣬��Ӧ���ʿ죬�¶�Խ�߷�Ӧ����Խ�죬��T2��T1 �� ��D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ�����й��������ԡ���ԭ�Ե��ж���ȷ����
A. B�������ӵ������Ա�A��������ǿ��˵��AԪ�صĽ�����һ����BԪ��ǿ
B. ����������ԭ��Ӧʱ��Aԭ��ʧȥ���ӱ�Bԭ�Ӷ࣬��A�Ľ�����һ����Bǿ
C. ������Na2O2���������з�̪��ˮ�У���Һ��Ϊ��ɫ
D. һ����������ͨ��30mL10.00mol/L������������Һ�У����Ⱥ��γ�NaCl��NaClO��NaClO3�������Һ������Ӧ��ת�Ƶĵ���Ϊnmol����0.15<n<0.25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1L1mol/LH2SO4��Һ��2L1mol/LNaOH��Һ��ȫ��Ӧ���ų�114.6kJ���������ɴ���֪H2SO4��NaOH�����кͷ�Ӧ���к���Ϊ �� ��ʾ���к��ȵ��Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ͬ�����£������������������������ֱ���ȫȼ�գ����߷ų�������
B.�ɡ�C��ʯī��=C�����ʯ������H=+119kJ?mol��1����֪�����ʯ��ʯī�ȶ�
C.��101KPaʱ��2g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��H2��g��+ ![]() O2��g��=H2O��l������H=+285.8 kJ?mol��1
O2��g��=H2O��l������H=+285.8 kJ?mol��1
D.��ϡ��Һ�У�H+��aq��+OH����aq��=H2O��l������H=��57.3l kJ?mol��1 �� ������0.5mol H2SO4��Ũ������l mol NaOH��Һ��ϣ��ų�����������57.31 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ�����������������ȷ���ǣ� ��
A. ������������ȼ�գ�������ɫ����
B. ��˿��������ȼ�գ����ɺ���ɫ��
C. ����������ȼ�գ����ɰ�ɫ����
D. ͭ˿��������ȼ�գ�������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017����٣����ռ�¼Ƭ��������Ҫ��ѧ����������Ȧ������˵���������һ�µ��ǣ� ��
A. ˮʲôʱ������� B. ����ױƷ����Ȼ�������κλ�ѧ����
C. ���ø�Ƭ����Ԥ����ð D. ��ѧ����������Ľ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A. �Ҵ��Ͷ����ѻ�Ϊͬ���칹��
B. 35Cl��37Cl��Ϊͬλ��
C. �����Ӳ֬�ụΪͬϵ��
D. ���Ͱ���Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ʯȼ��˵����ȷ���ǣ�������
A. ú�ӹ��õ���ˮú���������ϳ�Һ̬�����״��Ⱥ����л���
B. ʯ���ѻ���Ŀ����Ϊ�˵õ���̬������
C. ��Ȼ������Ҫ�ɷ��Ǽ��飬���ڿ�������Դ
D. ú�к��б��Ͷ��ױ������ʣ���ͨ��ú�ĸ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,���ڷǵ����,������ˮ��������Һ������������ǿ����(����)
A.������B.�Ҵ�C.�����D.��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com