
【题目】【题目】下列关于氧化性、还原性的判断正确的是
A. B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强
B. 发生氧化还原反应时,A原子失去电子比B原子多,则A的金属性一定比B强
C. 将少量Na2O2固体加入滴有酚酞的水中,溶液变为红色
D. 一定量的氯气通入30mL10.00mol/L的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为nmol,则0.15<n<0.25
【答案】D
【解析】A.若B为多价态金属,则B的金属性不一定比A弱,若Fe3+的氧化性大于Cu2+的氧化性,而金属性Fe>Cu,故A错误;B.发生氧化还原反应时,由失去电子的难易可判断金属性,不能利用失去电子数目的多少来判断,故B错误;C.过氧化钠具有强氧化性,将少量Na2O2固体加入滴有酚酞的水中,溶液变为红色,然后褪色,故C错误;D.由Cl2+2NaOH =NaCl +NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.3mol×![]() ×1=0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.3mol×
×1=0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.3mol×![]() ×1=0.25mol,故D正确;故选D。
×1=0.25mol,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
【实验目的】探究 ________________ 。
【提出假设】猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
【设计实验】取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1 L和V2 L(所测定的气体体积已折合成标准状况)。
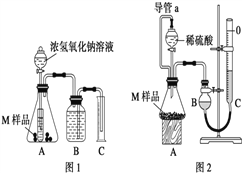
(1)完成实验目的和猜想填空内容。
(2)若该实验需要0.50mol/LNaOH溶液 180mL,按中学常用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积 _______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想 ________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1 ________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0 ,则M样品中铁的质量为____________g(用含V1和V2式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( ) 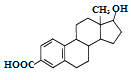
A.该有机物的分子式为C19H22O3
B.该分子中所有碳原子不可能在同一个平面内
C.能发生加成反应、取代反应、水解反应
D.能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂﹣磷酸氧铜电池正极的活性物质是Cu4O(PO4)2 , 可通过下列反应制备: 2Na3PO4+4CuSO4+2NH3H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
请回答下列问题:
(1)写出基态Cu2+的外围电子排布式: . C、N、O三种元素的第一电离能由小到大的顺序为(用元素符号表示).
(2)PO43﹣的空间构型是 .
(3)比较CuSO4晶体与干冰熔点相对高低,并解释原因 .
(4)氨基乙酸铜的分子结构如图,其中碳原子的杂化方式为 .
(5)在硫酸铜溶液中加入过量氨水,生成配合物离子四氨合铜,请写出四氨合铜离子的结构式 .
(6)铁和铜是重要的金属,Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.六氰合亚铁离子[Fe(CN)6]4﹣中不存在 .
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(7)NaCl晶胞中若r(Na+)=a pm,r(Cl﹣)=b pm,则NaCl晶胞的空间利用率为 . (晶胞中离子以密堆积方式存在,用含有a,b的列式表示) 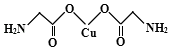
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X=A↑+2B↑+4C↑。测得反应后生成的混合气体对H2的相对密度为d,在相同条件下,X的相对分子质量是
A. 2d B. 7d C. 5d D. 3.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1>P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼是一种重要的化工原料,某同学设计的三氯化硼制备装置如图. 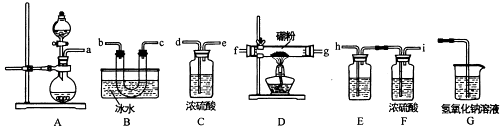
【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl ![]() 2BCl3+3h2
2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
(1)A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为 .
(2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为 .
(3)装里E中的试剂为 . 如果拆去E装置,可能的后果是 .
(4)D装置中发生反应前先通入一段时间的氯气,其目的是 . 该装置中发生反应的化学方程式为 .
(5)三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式 .
(6)请设计一个简易实验,验证制得的产品中是否含有硼粉 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=;若温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 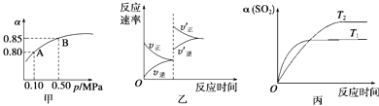
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com