
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
【实验目的】探究 ________________ 。
【提出假设】猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
【设计实验】取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1 L和V2 L(所测定的气体体积已折合成标准状况)。
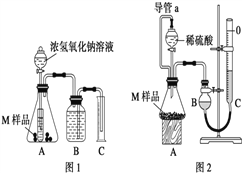
(1)完成实验目的和猜想填空内容。
(2)若该实验需要0.50mol/LNaOH溶液 180mL,按中学常用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积 _______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想 ________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1 ________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0 ,则M样品中铁的质量为____________g(用含V1和V2式子表示)
【答案】 M的成分 铜和铝 5.0 偏大 无影响 平衡压强,使硫酸顺利流下 1 = 0.25(V2—V1)
【解析】实验目的:探究准晶体样品M的成分及含量;关于样品M组成的猜想:两种金属的混合物,有三种情况:铁和铜、铁和铝,还有一种情况是铜和铝;(2)若该实验需要0.50mol·L-1NaOH溶液 180mL,配溶液要用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol·L-1×0.25L×40g·mol-1=5.0g;62gNa2O,溶于水能生成2molNaOH,每31g就能获得1molNaOH,若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度偏大;(3)如果实验前B瓶液体没有装满水,不影响实验结果,因为理论上B管收集的气体体积等于排入C管里液体的体积;实验2中的导管a的作用为平衡压强,使硫酸顺利流下,并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。(4))若实验1测出有气体产生,说明一定有铝与氢氧化钠反应,猜想1不成立.因为铁和铜都不能与氢氧化钠反应.猜想3成立,M为铜和铝,实验1和实验2使用的样品M质量相等,铜不参与反应,产生的气体体积相等;(5)若猜想2成立,即样品M的成分是铁和铝,则V2-V1即为铁与盐酸反应生成的氢气,所以铁的质量为: ![]() ,则样品M中铁的质量分数为
,则样品M中铁的质量分数为![]() 。
。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,生成沉淀的物质的量可能是( )
①a mol ②b mol ③![]() mol ④
mol ④![]() mo l ⑤0 mol ⑥(4a-b)mol
mo l ⑤0 mol ⑥(4a-b)mol
A. ①②③④⑤⑥ B. 只有①③④⑤ C. ①③④⑤⑥ D. 只有①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是认识和研究化学物质常用方法。
Ⅰ.在下列物质中:①水银 ②烧碱 ③熔化的KCl ④氯化钠晶体 ⑤盐酸 ⑥碳酸氢钠固体 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩氢氧化钡溶液
(1)能导电的是_________,属于电解质的是__________,属于非电解质的是________。(填编号于空格中)
(2)写出物质⑥溶于水的电离方程式:____________________________。
(3)将物质⑥配制成溶液,逐滴加入⑩溶液至沉淀量最大,该反应的离子方程式:______________。
Ⅱ下列物质存在如下转化关系:
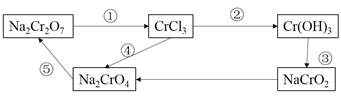
(1)在上述有编号的步骤中,需用还原剂的是_____(填编号,下同),需用氧化剂的是___。
(2)从转化关系可知Cr(OH)3为两性氢氧化物,试着写出其与KOH反应的离子方程式:___________________________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol
B.CO(g)的燃烧热是﹣283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0 kJ/mol
O2(g)═CO2(g)△H=﹣283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 .
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数 K= .
[已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 . 
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素锶(38Sr,ⅡA族)的叙述最不可能的是
A. 其氯化物是离子化合物
B. 其最高价氧化物水化物为一种弱碱
C. 它比Ca更易置换水中的氢
D. 它的碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如图: 
(1)用NaOH溶液处理废旧锌铁皮发生反应的化学方程式为 .
(2)①若溶液A中滴加稀H2SO4过量,会溶解产生的Zn(OH)2 , 可改用的方法是 . ②由Zn(OH)2灼烧制ZnO前需进行洗涤,检验沉淀洗涤是否干净的方法是 .
(3)流程中加人NaClO3发生反应的离子方程式为 .
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是 . ②溶液B中主要发生的离子反应方程式为 .
③确定溶液B中含有Fe2+的实验方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列关于氧化性、还原性的判断正确的是
A. B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强
B. 发生氧化还原反应时,A原子失去电子比B原子多,则A的金属性一定比B强
C. 将少量Na2O2固体加入滴有酚酞的水中,溶液变为红色
D. 一定量的氯气通入30mL10.00mol/L的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为nmol,则0.15<n<0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com