
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 .
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数 K= .
[已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 . 
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 
【答案】
(1)2a+2b+c
(2)温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低)
(3)3138
(4)2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;
4CuSO4+4NH3+2H2O;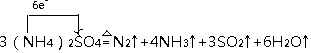 ;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
【解析】解:(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1; 盖斯定律计算目标反应的反应热为:①×2+②×2+③,2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=(2a+2b+c)KJ/mol,
故答案为:2a+2b+c;(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低),
故答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);(3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() =
= ![]() =3138,
=3138,
故答案为:3138;(4)①将黄铜精矿主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合电子守恒和原子守恒配平书写,反应的化学方程式为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O,
4CuSO4+4NH3+2H2O,
故答案为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写得到化学方程式为:3(NH4)2SO4
4CuSO4+4NH3+2H2O;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写得到化学方程式为:3(NH4)2SO4 ![]() N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ , 单线桥标出电子转移的方向及数目为:
N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ , 单线桥标出电子转移的方向及数目为: 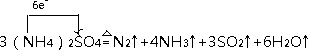 ,
,
故答案为: 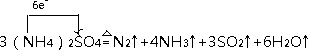 ;
;
③根据复分解反应发生的条件和图象中物质溶解度分析,常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行,工业上制备K2SO4晶体的设计思路是:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤得到,
故答案为:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤;
(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1;目标反应的反应热为:①×2+②×2+③,由此分析解答;(2)根据图1分析,60℃氧化速率最快,温度过高(NH4)2SO3会分解; (3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() ;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;
;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( ) 
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.若用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中正确的是( ).
A. 离子化合物可能含共价键B. 共价化合物可能含离子键
C. 离子化合物中只含离子键D. 离子化合物不能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( ) 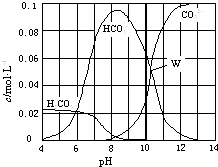
A.W点所示的溶液中:c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+)
B.pH=4的溶液中:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
C.pH=8的溶液中:c(Na+)>c(HCO3﹣)>c(H2CO3)>c(CO32﹣)
D.pH=11的溶液中:c(Na+)+c (H+)=c(OH﹣)+c(Cl﹣)+c(CO32﹣)+c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
【实验目的】探究 ________________ 。
【提出假设】猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
【设计实验】取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1 L和V2 L(所测定的气体体积已折合成标准状况)。
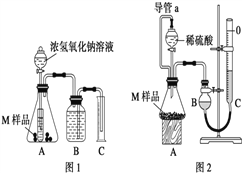
(1)完成实验目的和猜想填空内容。
(2)若该实验需要0.50mol/LNaOH溶液 180mL,按中学常用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积 _______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想 ________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1 ________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0 ,则M样品中铁的质量为____________g(用含V1和V2式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如下反应:
①![]() +Cl2=Br2+
+Cl2=Br2+![]() ,②
,②![]() +5Cl-+6H+=3Cl2+3H2O,
+5Cl-+6H+=3Cl2+3H2O,
③2FeCl3+2KI=2FeCl2+2KCl+I2,④2FeCl2+Cl2=2FeCl3。
下列各微粒氧化能力由强到弱的顺序正确的是( )
A. ![]() >
>![]() >Cl2>Fe3+>I2 B.
>Cl2>Fe3+>I2 B. ![]() >Cl2>
>Cl2>![]() >I2>Fe3+
>I2>Fe3+
C. ![]() >
>![]() >Cl2>Fe3+>I2 D.
>Cl2>Fe3+>I2 D. ![]() >
>![]() >Fe3+>Cl2>I2
>Fe3+>Cl2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )


A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1>P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.
C.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com