
【题目】能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2和O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
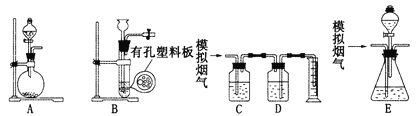
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2的化学方程式为______________________________。
(2)用B装置制CO2,使用该装置的优点是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
Ⅱ.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,C、D中盛放的药品分别是____、____(填序号):
①KMnO4溶液②饱和NaHSO3溶液③饱和Na2CO3溶液④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL·min-1,t1 min后,测得量筒内液体的体积为V mL则SO2的体积分数是_______________(写表达式)。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeC12和FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫的目的。写出催化剂参与反应过程的离子方程式:
①SO2+2H2O+2Fe3+==SO42-+2Fe2++4H+;②______________________________。
(7)若模拟烟气仍以a mL· min-1的流速直接通过转化器E装置,t2 min后,向E装置中加入足量的盐酸酸化的BaCl2溶液得到白色浑浊液,经_______、 洗涤、_____、称量,得到m g固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表,下列叙述中不正确的是( )。
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.周期表中位置靠近的元素性质相近
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常条件下,下列各组物质的性质排列正确的是( )
A.熔点:Na>MgO>SiO2
B.水溶性:SO2>H2S>HCl
C.热稳定性:HF>H2O>NH3
D.沸点:HF>HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.纯铁比生铁更耐腐蚀
B.明矾水解形成胶体能吸附悬浮物,可用于净水
C.碳酸钠溶液呈碱性是因为其在水中电离出OH-
D.工业废水中的Cu2+和Hg2+可用Na2S或H2S除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁化合物具有广泛用途。请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的____,还生成少量的______(填化学式);
(2)CH3MgCl是一种重要的有机合成试剂,其中镁的化合价是___________,该化合物水解的化学方程式为____________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
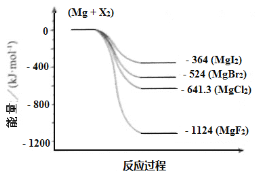
下列选项中正确的是_____________(填序号)。
① MgI2中Mg2+ 与I- 间的作用力小于MgF2中Mg2+ 与F- 间的作用力
② Mg与F2的反应是吸热反应
③ MgBr2与Cl2 反应的△H > 0
④ 化合物的热稳定性顺序为MgI2 < MgBr2 < MgCl2 < MgF2
⑤ MgF2(s) + Br2(l) = MgBr2(s) + F2(g) △H = +600 kJ · mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )。
A.带相反电荷离子之间的相互吸引力称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间也可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() Mn0(s)+CO2(g)△H1 K1
Mn0(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n)+O2(g)![]() 2MnO2(s)+2CO2(g)△H3 K3
2MnO2(s)+2CO2(g)△H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s)![]() MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
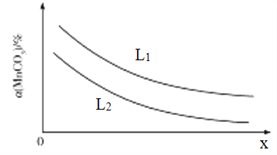
比较:L1__________L2(填“>"“<”或“=")。
②保持温度不变,将容器休积扩大至原来的2倍,则ρ(CO2)的变化范围是____________。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 放热反应在常温下一定很容易发生
C. 反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小
D. 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com