
【题目】含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2和O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
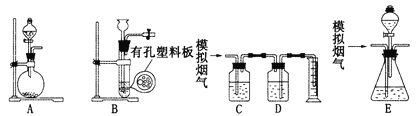
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2的化学方程式为______________________________。
(2)用B装置制CO2,使用该装置的优点是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
Ⅱ.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,C、D中盛放的药品分别是____、____(填序号):
①KMnO4溶液②饱和NaHSO3溶液③饱和Na2CO3溶液④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL·min-1,t1 min后,测得量筒内液体的体积为V mL则SO2的体积分数是_______________(写表达式)。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeC12和FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫的目的。写出催化剂参与反应过程的离子方程式:
①SO2+2H2O+2Fe3+==SO42-+2Fe2++4H+;②______________________________。
(7)若模拟烟气仍以a mL· min-1的流速直接通过转化器E装置,t2 min后,向E装置中加入足量的盐酸酸化的BaCl2溶液得到白色浑浊液,经_______、 洗涤、_____、称量,得到m g固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是_________________.
【答案】 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 可以随时控制反应的发生 ① ④ (at1-V)/at1×100% 4Fe2++O2+4H+=2H2O+4Fe3+ 过滤 干燥 22400mat1/[233at2(at1-V)]×100%
【解析】试题分析:Ⅰ.(1)实验室制备SO2是用浓硫酸与亚硫酸钠反应,反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑。
(2)B装置是简易启普发生器,其优点是可以随时控制反应的发生和停止。
Ⅱ.(4)由于SO2易溶于水,所以C装置中的试剂应该是原来吸收SO2,可以利用SO2的还原性借助于酸性高锰酸钾溶液氧化。CO2气体能溶于水,所以D装置应该用饱和碳酸氢钠溶液通过排水法收集液体来测量SO2的体积。
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,这说明混合气中CO2、氮气和氧气的体积之和为Vml,则SO2的体积是t1amL-Vml,所以二氧化硫的体积分数是![]() ×100%=
×100%=![]() ×100%。
×100%。
(6)催化剂在反应前后是不变的,因此常温下,若它可催化SO2与O2的反应,以达到脱硫目的。则根据第一步反应SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+可知,第二步反应一定是氧气再将亚铁离子转化为铁离子,则反应的离子方程式为4Fe2++O2+4H+=2H2O+4Fe3+。
(7)所得白色沉淀是硫酸钡,层溶液中分离出硫酸钡的操作应该是过滤、洗涤、干燥、称量。根据(5)中SO2的含量可知,理论上应该生成硫酸钡的质量为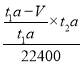 ×233,因此该转化器的脱硫效率是
×233,因此该转化器的脱硫效率是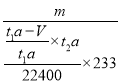 =
=![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右图所示装置。试回答下列问题:
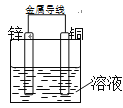
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的______极(填“正”或“负”),发生_______反应(填“氧化”或“还原”), 电极反应式为___________________;Cu棒上可观察到的现象是______________________,电极反应式为______________________________。
(2)若电解质为硫酸铜溶液,则Cu棒为原电池的______极(填“正”或“负”),发生_________反应(填“氧化”或“还原”),其电极反应式为____________________________________。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
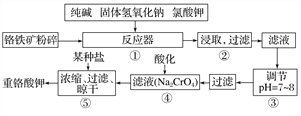
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO![]() 转化为Cr2O
转化为Cr2O![]() ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
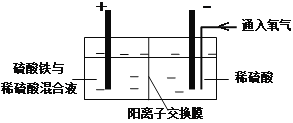
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的最高价氧化物对应的水化物不能和强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
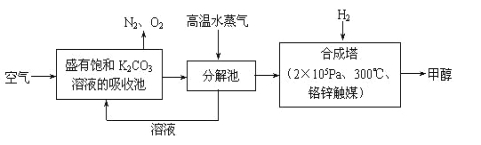
写出分解池中反应的化学方程式 。在合成塔中,当有4.4 kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(2)以CO2为碳源还可以制备乙醇,反应如下:
2CO2(g) + 6H2(g)=== CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。当电子转移 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)以甲醇为燃料还可制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质(可传导O2-)。该电池负极发生的电极反应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com