
【题目】(10分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
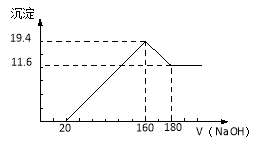
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
【答案】(1)4.8g (2)8mol/L
【解析】
试题分析:镁、铝合金投入盐酸生成氯化镁、氯化铝和氢气,向反应后的溶液中加入氢氧化钠溶液,当加入氢氧化钠溶液20mL时无沉淀,说明盐酸过量,20mL氢氧化钠中和过量的盐酸;当氢氧化钠溶液加至160mL时生成沉淀最多(氢氧化镁和氢氧化铝共19.4g),继续加入20mL氢氧化钠溶液,氢氧化铝溶解,最终仍有11.6g沉淀,此沉淀即为氢氧化镁的质量,n[Mg(OH)2]=0.2mol,由镁元素守恒得原合金中n(Mg)=0.2mol。当加入氢氧化钠溶液160mL时生成沉淀质量最多,此时溶液中溶质为氯化钠,n(Na+)=n(Cl-),Na+来自NaOH,Cl-来自HCl,所以n(NaOH)=n(HCl),0.16L×5 mol/L=c(HCl)×0.1L,c(HCl)=8mol/L。


科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
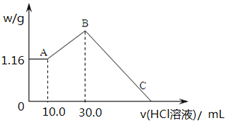
(1)A点的沉淀物的化学式为_________________。
(2)写出A点至B点发生反应的离子方程式:_____________________。
(3)某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:______________,________________,________________。
(4)原混合物中NaOH的质量是________g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B均为原子序数1﹣20的元素,已知A的原子序数为n,A2+离子比B2﹣离子少8个电子,则B的原子序数是( )
A.n+4
B.n+6
C.n+8
D.n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
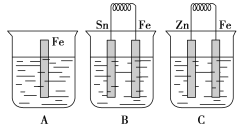
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________,Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。C中被腐蚀的金属是________,总反应的离子方程式为________________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,大量排放的B气体被雨水吸收后形成了________而污染环境。
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A________;C________。
②D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的化学方程式______________,该反应中还原剂和氧化剂之比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com