
【题目】在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
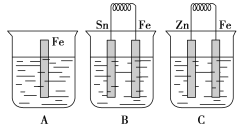
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________,Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。C中被腐蚀的金属是________,总反应的离子方程式为________________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
科目:高中化学 来源: 题型:
【题目】检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A. 用干燥的蓝色石蕊试纸
B. 用干燥有色布条
C. 将气体通入硝酸银溶液
D. 用湿润的淀粉碘化钾试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过氧化氢的叙述中不正确的是 ( )
A. 氧原子采取的是sp2杂化
B. 分子中有3个σ键
C. 过氧化氢是极性分子
D. 每个氧原子上有两个孤对电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以离子键为主的化学键中常含有共价键的成分.下列各对原子形成化学键中共价键成分最少的是( )
A. Na,F B. Al,O C. Li,Cl D. Mg,S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
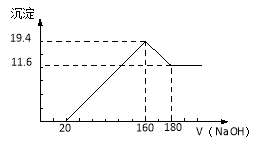
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
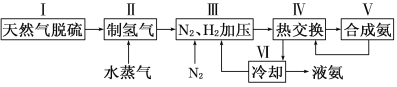
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定)。
(1)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(2)若改用排水法收集气体,则可收集到气体的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应: (1) 2Fe3++2I-= 2Fe2++I2 (2) Br2 + 2Fe2+= 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
A. Br- > I-> Fe2+ B. I- > Fe2+> Br- C. Fe2+> I-> Br- D. Br- > Fe2+> I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com