
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
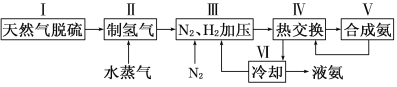
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
【答案】(1)1:3 逆向移动
(2)Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
(3)a 70%
【解析】
试题分析:(1)
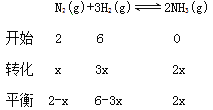
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是![]() 。正反应放热,升高平衡体系的温度(保持体积不变), 该反应逆向移动;(2)氯水中存在的一个化学平衡反应的离子方程式Cl2+H2O
。正反应放热,升高平衡体系的温度(保持体积不变), 该反应逆向移动;(2)氯水中存在的一个化学平衡反应的离子方程式Cl2+H2O![]() H++Cl-+HClO;(3)要提高平衡体系中H2百分含量,需要平衡正向移动;升高温度,平衡正向移动,速率加快;增大压强,平衡逆向移动,速率加快;加入催化剂,平衡不移动,速率加快;降低压强,平衡正向移动,速率减慢;设参加反应的CO 的物质的量为xmol
H++Cl-+HClO;(3)要提高平衡体系中H2百分含量,需要平衡正向移动;升高温度,平衡正向移动,速率加快;增大压强,平衡逆向移动,速率加快;加入催化剂,平衡不移动,速率加快;降低压强,平衡正向移动,速率减慢;设参加反应的CO 的物质的量为xmol
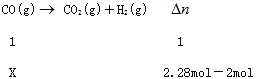
X=0.28mol;
则CO转化率为![]() 70%。
70%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:

图1
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是_____________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4用途广泛,以Cu为原料制CuSO4有多种方法。
(1)实验室可用Cu与浓硫酸反应制CuSO4。
① Cu与浓硫酸反应的化学方程式是________。
② 该方法制CuSO4存在的不足是________(写出任意一条)。
(2)实验小组采取如下方法制CuSO4。

实验表明,Fe3+能加快生成CuSO4的反应速率,加快原理可表述为:
i. 2Fe3+ + Cu = 2Fe2+ + Cu2+
ii. ……
ii的离子方程式是________。
(3)用电解的方法制CuSO4,如图所示。

① 与直流电源a 端相连的电极材料是________(填“铜片”或“石墨”)。
② 将进口处较浓硫酸替换为Na2SO4溶液进行实验,发现得到的CuSO4溶液pH比替换前升高,结合化学用语解释pH升高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
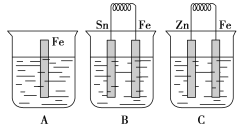
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________,Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。C中被腐蚀的金属是________,总反应的离子方程式为________________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属锌与浓硫酸的反应来说,下列说法不当的是( )
A.若金属锌足量,反应所放出的气体应为混合物
B.反应消耗的锌的物质的量一定等于反应生成的气体的物质的量
C.反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍
D.由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析离子反应 xR2++yH++O2═mR3++nH2O,下列说法中正确的是( )
A.n=2,H2O是氧化产物
B.x=y=m=4
C.该反应中R2+得到电子,被氧化为R3+
D.任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B. Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C. 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D. Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2015年9月3日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )

A.“彩雾”是一种混合物
B.上述过程中有物理变化
C.燃料燃烧产生的热量促使拉烟剂气化
D.“彩雾”的形成与焰色反应的原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com