
����Ŀ���������ֳ����£�N2H4����ɫҺ������һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ_____________�����е��Ļ��ϼ�Ϊ______________��
��2��ʵ���ҿ��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ___________��
��3����2O2��g��+N2��g��=N2O4��l����H1
��N2��g��+2H2��g��=N2H4��l����H2
��O2��g��+2H2��g��=2H2O��g����H3
��2N2H4��l��+N2O4��l��=3N2��g��+4H2O��g����H4=-1048.9kJ/mol
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4=____________��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ________________��
��4������Ϊ��Ԫ�����ˮ�еĵ��뷽��ʽ�백���ơ������������γɵ���ʽ�εĻ�ѧʽΪ ��
��5��������һ�ֳ��õĻ�ԭ���������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�������ɳ�ȥˮ���ܽ��O2 kg����ʹ��Na2SO3����ˮ���ܽ��O2��ȣ��������ŵ��� ��
���𰸡���1��![]() ��2��
��2��
��2��2NH3+NaClO![]() N2H4+NaCl+H2O��
N2H4+NaCl+H2O��
��3��2��H32��H2��H1 ����Ӧ��������������������
��4��N2H6��HSO4��2����5��1��N2H4������������������������������������Ϊ����Ⱦ�ĵ�����ˮ����
��������
�����������1�������Ļ�ѧʽΪN2H4�������ʽΪ��![]() ��������H��+1�ۣ����ݻ��ϼ۵Ĵ�����Ϊ0�����N�ԣ�2�ۣ���2��NaClO����������Cl�ɣ�1������1�ۣ�NH3��N�ɣ�3������2�ۣ����ݻ��ϼ�������������ƽ����˷�Ӧ����ʽΪ��2NH3��NaClO=N2H4��NaCl��H2O����3�����ݸ�˹���ɣ�2������2���������ó�����H4=2��H3��2��H2����H1���ƽ�������Ҫԭ��ų��������ȺͲ������������壻��4�����������ᷴӦ��������ʽ�Σ�˵��ֻ�к������е�1���⣬���N2H4��2H2SO4=N2H6��HSO4��2����5�����ݵ�ʧ������Ŀ�غ㣬n��N2H4����2��2=n��O2����4��n��N2H4��=1��103/32mol�� ���n��O2��=103/32mol��������Ϊ1kg����������������������ĵ�Na2SO3������Ϊ103��2��126/32g������������ŵ��ǣ�N2H4�������٣���������������������������Ϊ����Ⱦ�ĵ�����ˮ����
��������H��+1�ۣ����ݻ��ϼ۵Ĵ�����Ϊ0�����N�ԣ�2�ۣ���2��NaClO����������Cl�ɣ�1������1�ۣ�NH3��N�ɣ�3������2�ۣ����ݻ��ϼ�������������ƽ����˷�Ӧ����ʽΪ��2NH3��NaClO=N2H4��NaCl��H2O����3�����ݸ�˹���ɣ�2������2���������ó�����H4=2��H3��2��H2����H1���ƽ�������Ҫԭ��ų��������ȺͲ������������壻��4�����������ᷴӦ��������ʽ�Σ�˵��ֻ�к������е�1���⣬���N2H4��2H2SO4=N2H6��HSO4��2����5�����ݵ�ʧ������Ŀ�غ㣬n��N2H4����2��2=n��O2����4��n��N2H4��=1��103/32mol�� ���n��O2��=103/32mol��������Ϊ1kg����������������������ĵ�Na2SO3������Ϊ103��2��126/32g������������ŵ��ǣ�N2H4�������٣���������������������������Ϊ����Ⱦ�ĵ�����ˮ����


 �ŵ������ϵ�д�
�ŵ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������У�����10 mol N2��30 mol H2��������ӦN2(g)+3H2(g)![]() 2NH3(g)����һ�������´ﵽƽ��ʱ��N2��ת����Ϊ25%������ͬһ�����У�����ͬ�¶��£��������г���NH3����ʹ�ﵽƽ��ʱ���ɷֵ���������������ƽ����ͬ������ʼʱNH3�����ʹﵽƽ��ʱNH3��ת����Ϊ
2NH3(g)����һ�������´ﵽƽ��ʱ��N2��ת����Ϊ25%������ͬһ�����У�����ͬ�¶��£��������г���NH3����ʹ�ﵽƽ��ʱ���ɷֵ���������������ƽ����ͬ������ʼʱNH3�����ʹﵽƽ��ʱNH3��ת����Ϊ
A. 20 mol��25% B. 20 mol��75% C. 40 mol��30% D. 10mol��50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������A��B��Ӧ����C���䷴Ӧ���ʷֱ���v��A����v��B����v��C����ʾ����֪v��A����v��B����v��C��֮�������¹�ϵ2v��B��=3v��A����3v��C��=2v��B������˷�Ӧ�ɱ�ʾΪ
A��2A+3B=2C B��A+3B=C C��3A+B=2C D��A+B=C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���Ʊ�ʵ���ǻ�ѧʵ���ѧ��һ������ʵ�飬ijѧϰС���������������ʵ�鷽����
ʵ��һ��
��ͭ������ϡ���ᷴӦ��ʵ������ͭ��Ũ�������ʹ֮��ȫ��Ӧ������Һͨ���������ᾧ�Ȳ����õ�����ͭ���塣
��1����������ʵ��ͷ�Ӧ���Ƚ�Ũ������ϡ��������ʣ�Ũ������� ��
��2���÷�Ӧ�Ļ�ѧ����ʽΪ ��
ʵ�����
�Կ���Ϊ��������һ����������������������ֱ��ͨ�뵽ͭ����ϡ����Ļ�����У��䷴Ӧԭ��Ϊ2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ������Ӧ����̫�����������¶ȵ�80��90������Ӧ��Ȼ����������ͭ�ۺ�ϡ����Ļ�����м�������Fe2(SO4)3��Һ�����������Լӿ졣
��3��Fe2(SO4)3�������� ��
��4���õ��Ļ��Һ�������������������е� ������Һ��pH =2��4��ʹFe3+ �γ�Fe(OH)3��������ȥ��
A��NaOH B�� CuO C�� CuCO3 D��Fe
��5��������������ݣ���������ʵ�鷽���������ۣ����±���
ʵ �� ��һ�� | ʵ �� ������ | |
��Ҫ�ŵ� | ������� | ��1��ԭ�ϳ��ת��Ϊ��Ʒ ��2��û���к������ŷ� |
��Ҫȱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ů����ȡůƬ�IJ����к������ۡ�ˮ������̿����ʯ��ʳ�ε��������һ��ԭ����ڷ�Ӧʱ�ͷų�����,������ԭ����г䵱
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ�������ɿ���ָ�����ǽ��й����Ե��Ʋ���жϡ�����˵������������( )
A. ��ˮ��Һ�����ԣ�HCl��HF�������ƶϳ�Ԫ�صķǽ����ԣ�Cl��F
B. ���ǿ��������ڱ��Ĺ���Ԫ����Ѱ�Ҵ�������ʴ�����µĺϽ����
C. ������Ԫ�������ϼ���ֵ������������ͬ
D. ������Ԫ���γɵ���X2����Y2����������Ų���ͬ�����Ӱ뾶��X2����Y2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ü۲���ӶԻ�������Ԥ��H2S��BF3�Ŀռ乹�ͣ����н�������ȷ����(��)
A. ֱ���Σ������� B. V�Σ�������
C. �������壻�������� D. V�Σ�ƽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ��
��HF(aq)��OH��(aq)=F��(aq)��H2O(l)��H1����67.7kJ��mol��1
��H��(aq)��OH��(aq)=H2O(l)��H2����57.3kJ��mol��1
��Ba2��(aq)��SO42��(aq)=BaSO4(s)��H3��0
����˵����ȷ����( )
A. HF�ĵ��뷽��ʽ����ЧӦ��HF(aq)![]() H��(aq)��F��(aq) ��H��0
H��(aq)��F��(aq) ��H��0
B. ������������Һ������ķ�Ӧ�У�����������Һ��Խ�࣬�к���Խ��
C. ��H2����57.3 kJ��mol��1��ǿ���ǿ����ϡ��Һ�з�Ӧ���ɿ����ε��к���
D. ϡ������ϡ����������Һ��Ӧ���Ȼ�ѧ����ʽΪH2SO4(aq)��Ba(OH)2(aq)=BaSO4(s)��2H2O(l)��H����114.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4,7�����㶹��(�۵㣺132.6 ��)��һ����Ҫ�����ϣ��㷺�ֲ���ֲ����У��ɼ������Ϊԭ�ϵĺϳɷ�Ӧ���£�
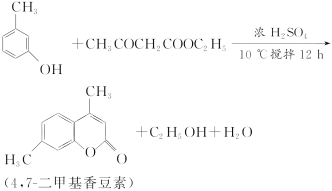
ʵ��װ��ͼ���£�

��Ҫʵ�鲽�裺
����1����װ��a�м���60 mLŨ���ᣬ����ȴ��0 �����£������µ���������30 mL(0.29 mol)��������������26.4 mL(0.21 mol)�Ļ���
����2��������10 ���£�����12 h����Ӧ��ȫ���䵹���ˮ������У�Ȼ����ˡ�ˮϴ�ôֲ�Ʒ��
����3���ֲ�Ʒ���Ҵ��ܽⲢ�ؽᾧ���ð�ɫ��״���岢��ɣ��Ƶò�Ʒ����Ϊ33.0 g��
(1)����װ��b�н��������²�����ͨ��Ŀ��________________________��
(2)ŨH2SO4��Ҫ��ȴ��0 �����µ�ԭ����__________________________��
(3)��Ӧ��Ҫ����12 h����ԭ����_________________________________��
(4)����ʵ�����Ϊ________��(�ٷ�������һλС��)
(5)ʵ�����Ʊ����������Ļ�ѧ��Ӧ����ʽ��_____________________________����________(��ҩƷ����)�ռ��ֲ�Ʒ����________(���������)�ķ����Ѵֲ�Ʒ���롣
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com