
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)2C(g);ΔH>0(表示吸热)。平衡移动关系如图所示,下列说法正确的是( )
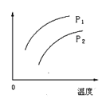
A.P1>P2,纵坐标指C的质量分数B.P1<P2,纵坐标指A的质量分数
C.P1<P2,纵坐标指A的转化率D.P1<P2,纵坐标指混合气体的平均摩尔质量
【答案】A
【解析】
根据题中A(g)+2B(g)2C(g);ΔH>0(表示吸热)可知,本题考查化学平衡的影响因素,运用勒夏特列原理分析。
A(g)+2B(g)2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,
A.P1>P2,压强增大平衡正向移动,C的质量分数增大,温度升高平衡正向移动,C的质量分数增大,则与图象符合,故A正确;
B.P1<P2,压强增大平衡正向移动,A的质量分数减小,温度升高平衡正向移动,A的质量分数减小则与图象不符合,故B错误;
C.P1<P2,压强增大平衡正向移动,A的转化率增大,则纵坐标不能为A的转化率,故C错误;
D. 由反应可知反应前后气体的总质量不变,P1<P2,压强增大平衡正向移动,总物质的量减小,则混合气体的平均摩尔质量增大,与图象不符,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100 mol/L,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是

A. 298K时,加蒸溜水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变
B. 0.1 mol/L HCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C. 298K时,HCOOH的电离常数Ka=1.0×10-3.75
D. 0.1 mol/L HCOONa溶液和0.1 mol/L HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
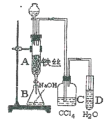
(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废液(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如图:
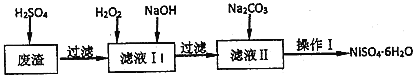
已知: 25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有________。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液I中加入6%的H2O2,其作用是__________(用离子方程式表示);加入NaOH调节pH的范围是_________,为了除去溶液中的_________离子。
(3)检验Ni2+已完全沉淀的实验方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A. N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B. H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C. N2(g)+3H2(g) ![]() 2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
D. 2SO2(g) +O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
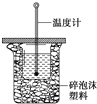
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值__________(填“偏大”、“偏小”或“无影响”);
(3)实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热_______(填“相等”或“不相等”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。
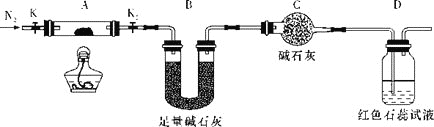
①连接好装置,点燃酒精灯之前,需进行的必要操作是___。
②反应结束后,依然要通一段时间的氮气的原因是___。
③加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600g,配成500mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20.00mol·L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①若滴定终点时,仰视读数,则测定结果___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中N的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在产生了AgCl沉淀的试管中,加入KI溶液,白色沉淀变为黄色。下列说法正确的是( )
A.该实验说明I-还原性比Cl-强B.该实验说明Ksp(AgCl)<Ksp(AgI)
C.该实验说明AgI溶解度比AgCl小D.KI的加入对AgCl的溶解平衡没有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com