
����Ŀ�������ҹ�����ϲ������Ʒ������ijУ��ѧ��ȤС���ͬѧ�������ʵ�������Լ����Ҷ�к���Ca��Al��Fe����Ԫ�ء�
��֪�������[(NH4)2C2O4]����������ʡ������(CaC2O4)������ˮ��Ca2����Al3����Fe3����ȫ������pHΪCa(OH)2��pH��13��Al(OH)3��pH��5.5��Fe(OH)3��pH��4.1��
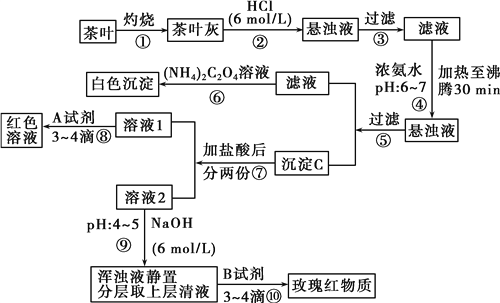
������������̼���Ϣ��գ�
��1������ڼ������������________________��
��2��д������Ca2�������ӷ���ʽ__________________________��
��3��д������C������Ҫ���ʵĻ�ѧʽ________________________��
��4��д���������A�Լ����ɺ�ɫ��Һ�����ӷ���ʽ__________________________��
��5��������������_____________________________________��
��6����ȡ400 g��Ҷ��Ʒ���յûҷۺ�������������ˣ���������Һ���������(NH4)2C2O4��Һ���ٹ��ˡ�ϴ�ӡ���������õ�5.12 g������ԭ��Ҷ�и�Ԫ�ص���������Ϊ________��
���𰸡� ʹCa2����Al3����Fe3������(��ʹCa2����Al3����Fe3���ܽ�) Ca2����(NH4)2C2O4===CaC2O4����2NH�� Fe(OH)3��Al(OH)3 Fe3����3SCN��Fe(SCN)3 ʹFe3��ת��ΪFe(OH)3���� 0.400%
����������Ҷ�����գ���Ҷ���к��иơ����������ֽ���Ԫ�أ��������������ɿ����Ե��Ȼ�������˺�����Һ�м��백ˮ����pH6��7����������30min�������˵õ��ij���CΪ��������������������������ҺΪ�Ȼ�����Һ���������狀�ɵò���Ƴ���������Һ�м���������Ϊ���ݣ������Լ�A����Һ��ɺ�ɫ����AӦΪKSCN��Һ����Һ2�м���6mol/L��NaOH��Һ��pH��4���ɵõ�����������������Һ���÷ֲ���ϲ���ҺΪ�Ȼ�����Һ�������Լ�B�ɼ��������ӣ����ɺ�ɫ������1��������������֪����������Ҷ�ҷ��м�����������ǽ����е�Ca2+��Al3+��Fe3+�ܽ⣻��2���ݹ��˺�������Һ�к�Ca2+������Ca2+�����ӷ���ʽΪ��Ca2++��NH4��2C2O4=CaC2O4��+2NH4+����3���������pHΪ6-7ʱ����30 min����ʹAl3+��Fe3+ת���ɳ�����������CΪAl(OH)3��Fe(OH)3��������4��������Ǽ���Fe3+���ɼ���KSCN ��NH4SCN���м��飬��Һ���ɫ����Ӧ�����ӷ���ʽΪ��Fe3++3SCN-=Fe(SCN)3����5������ὫpHֵ������4��5����ʱ������û�г����������ӳ�����ȫ������ʹFe3+ת��ΪFe(OH)3��������6��5.12g����ΪCaC2O4����CaԪ�ص�����Ϊ5.12g��![]() ��100%=1.6g����ԭ��Ҷ�и�Ԫ�ص���������Ϊ
��100%=1.6g����ԭ��Ҷ�и�Ԫ�ص���������Ϊ![]() ��100%=0.400%��
��100%=0.400%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. �Ȼ����Һ����ˮϡ��ʱ��c(NH4+)/c(Cl-)��ֵһ����С
B. 0.1 mol��L-1�������0.1 mol��L-1������HA��Һ�ֱ��ˮϡ��10����pH(HA) > pH(����)
C. ��֪25��ʱ��HA��Ka=6.25��10��5����pHΪ5.0ʱ��HA��Һ�� = 0.16
= 0.16
D. ij��Ԫ�����ʽ��NaHA��Һ�б�Ȼ���ڣ�c(H+)+c(A2��)=c(OH��)+c(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)��
A. ������ӦҲ���ڼӳɷ�Ӧ
B. ������Ӧ��������ȥ�Ȼ��е��ǻ�,����ȥ�ǻ��е���ԭ������ˮ
C. Ũ������������Ӧ��ֻ�����������
D. ��ʹ������Ӧ���ɵ������벢�ᴿ,���Խ�������ͨ���������뱥��̼������Һ��Һ����,���÷�Һ©������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£����������Ϻ����һ���������仯����(����)
A.H2��O2B.NH3��HClC.NO��O2D.SO2��H2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ����101 kPa�£�0.5 mol����C8H8ȼ�����ɶ�����̼��Һ̬ˮʱ�ų�2 759 kJ��������ʾ������Ӧ���Ȼ�ѧ����ʽ��ȷ����(����)
A. C8H18(l)��![]() O2(g)===8CO2(g)��9H2O(g) ��H����48.40 kJ��mol��1
O2(g)===8CO2(g)��9H2O(g) ��H����48.40 kJ��mol��1
B. C8H18(l)��![]() O2(g)===8CO2(g)��9H2O(l) ��H����5 518 kJ��mol��1
O2(g)===8CO2(g)��9H2O(l) ��H����5 518 kJ��mol��1
C. C8H18(l)��![]() O2(g)===8CO2(g)��9H2O(l) ��H����5 518 kJ��mol��1
O2(g)===8CO2(g)��9H2O(l) ��H����5 518 kJ��mol��1
D. 2C8H18(l)��25O2(g)===16CO2(g)��18H2O(l) ��H����11 036 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����Һ�п��ܴ�������Ag+ �� Mg2+ �� Cu2+�еļ������ӣ�
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ������� ��
��2��ȡ����ԭ��Һ�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ��˵��ԭ��Һ�п϶��е������� �� �йص����ӷ�ӦʽΪ ��
��3��ȡ��2������Һ�������NaOH��Һ�����ְ�ɫ������˵��ԭ��Һ�п϶����ڵ������� ��
��4��ԭ��Һ�п��ܴ������ڵ�������������A��D�еģ�����ţ� ��
A.Cl��
B.CO ![]()
C.NO ![]()
D.OH�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������и�����ȫȼ��ʱ���������������ǣ� ��
A.CH4
B.C2H6
C.C3H6
D.C6H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ���ʢװ�ڲ������Լ�ƿ�е���
A. ���� B. ����� C. ˮ���� D. KOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش��������⣺
��1������������ͨ����ɫʯ����Һ�У����Թ۲쵽�������ǣ� �� ����������е�ԭ�� ��
��2����ij��ѧ��ȤС��ƻ�������������������ȡ��������Һ�����䷴Ӧԭ��Ϊ�����û�ѧ����ʽ��ʾ�� ��
��ʵ�������ƺ�4.0molL��1��NaOH��Һ��������ҺmL������2.24L��������״����ǡ����ȫ��Ӧ��
������250mL 4.0molL��1 NaOH��Һ��ʵ�鲽�裺
a��������Ҫ�������ƹ��������
b�������������ƹ���
c�����ձ��е���Һע������ƿ��������������ˮϴ���ձ��ڱ�2��3�Σ�ϴ��ҺҲע������ƿ��
d������������ˮ�ܽ�����õ��������ƹ��壬������ȴ��
e���Ǻ�ƿ�����������µߵ���ҡ�ȣ�
f������������ƿ�м�����ˮ���̶�����1cm��2cmʱ�����ý�ͷ�ιܼ�����ˮ����Һ����̶������У�
������ƽ�����������������ƹ����������g��
�������������ȷ����˳���� ��
������ʵ����Ҫ�IJ��������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com