
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka= =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中 =
= =
= =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】当光束通过下列分散系:①烟雾 ②稀硫酸 ③蒸馏水 ④鸡蛋清溶液,能观察到有丁达尔现象的是( )
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是( )
、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是( )
A. Al3+、Na+、SO![]()
B. Mg2+、CO![]() 、Br-
、Br-
C. Al3+、Mg2+、SO![]()
D. Al3+、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g) ![]() nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的变化如图所示。下列说法不正确的是( )
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的变化如图所示。下列说法不正确的是( )

A. 10 min时,曲线发生变化的原因是升高温度
B. 10 min时,曲线发生变化的原因是增大压强
C. 反应方程式中n=1
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=3的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向右移动,CH3COOH电离常数增大
B. 加入少量CH3COONa固体,平衡向右移动
C. 加入少量Na2CO3固体,平衡向右移动,c(H+)减小
D. 加入少量pH=3的硫酸,溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:t℃时的Ksp(AgCl)=1.8×10-10, Ksp(AgI)=1.0×10-16, Ksp(Ag2CrO4)=9.0×10-12。该温度下,下列说法正确的是
A. 溶解度大小顺序为AgCl > Ag2CrO4> AgI
B. 向AgNO3溶液中滴加少量氯化钠溶液出现白色沉淀,再滴加少量KI溶液出现黄色沉淀,可证明AgI比AgCl更难溶
C. 该温度下,AgCl可能转化为Ag2CrO4
D. 某溶液中含有Cl-、和I-,浓度均为0.050 mol/L ,向该溶液中逐渐滴加0.050 mol/L的AgNO3溶液时,c(Cl-)/ c(I-)=1.8×106
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有碳酸钠和碳酸氢钠固体混合物3.24g.结合内容回答:
(1)除去该混合物中的碳酸氢钠可采取的方法是 .
(2)若将该混合物加热至质量不再变化时,剩余固体质量为2.62g.计算原混合物中碳酸钠的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
已知:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
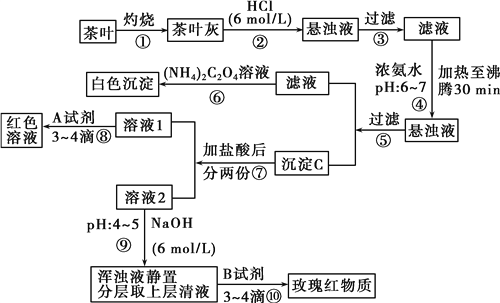
请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是________________。
(2)写出检验Ca2+的离子方程式__________________________。
(3)写出沉淀C所含主要物质的化学式________________________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式__________________________。
(5)步骤⑨的作用是_____________________________________。
(6)称取400 g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12 g沉淀,原茶叶中钙元素的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com