
【题目】将10.6 g Na2CO3溶解在10 mL水中,再稀释成1 L溶液,从中取出10 mL,这10 mL溶液的物质的量浓度为
A.0.1 mol·L-1B.1 mol·L-1C.0.01 mol·L-1D.10 mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
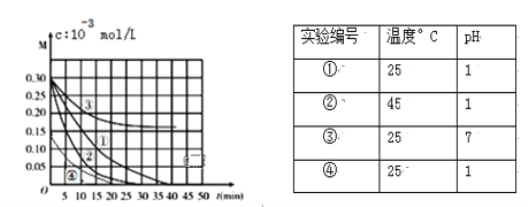
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
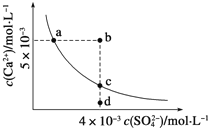
A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应:Fe+2Fe3+=3Fe2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式,负极:_____________,正极:__________;装置图:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为 ,下列关于半胱氨酸说法不正确的是
,下列关于半胱氨酸说法不正确的是
A. 能溶于水、乙醇等溶剂
B. 既能与盐酸、又能与NaOH溶液反应
C. 与 (高半胱氨酸)互为同系物
(高半胱氨酸)互为同系物
D. 官能团不变的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是____________(填序号)。
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-=Cu2+,发生氧化反应

Ⅱ锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(甲)所示.回答下列问题:

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是_________,电解质的主要成分是__________;
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是______________________。
(2)下图表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属).

①图(乙)中产物的化学式分别为A________,B________;
②操作a中得到熔块的主要成分是K2MnO4.操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑色固体,该反应的离子方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com