
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
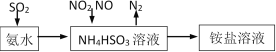
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
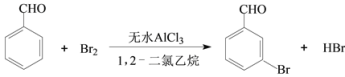
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
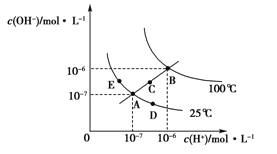
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
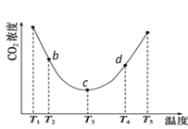
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
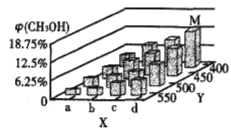
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Ca2CO3, XO2(X= Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)基态硼原子的价电子排布图是____________,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为________________。
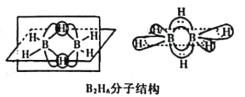
(2)B的简单氢化物BH3,不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为____________________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________,写出一种与氨硼烷互为等电子体的分子_________(填分子式)。
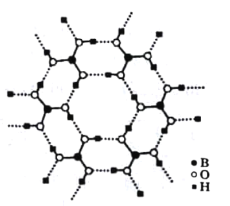
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为_______;硼酸在热水中比在冷水中溶解度显著增大的主要原因是____________。
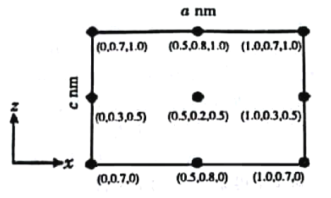
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为anm、bnm和cnm.如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_________;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____g·cm-3(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将V mL 0.10mol·L-1的NaOH溶液逐滴滴入到20.00mL 0.10mol·L-1的醋酸溶液中,溶液pH随所加V(NaOH)的变化而变化(忽略混合时溶液体积变化),数据如下表所示:

下列说法正确的是
A.①中存在c(CH3COO-)>c(Na+)=0.05mol·L-1
B.②中存在c(CH3COOH)<c(Na+)=c(CH3COO-)=x /(200+10x)
C.③中存在c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.05mol·L-1
D.通过①进行近似计算可知醋酸的数量级是10-6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com