
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Ca2CO3, XO2(X= Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)基态硼原子的价电子排布图是____________,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为________________。
(2)B的简单氢化物BH3,不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
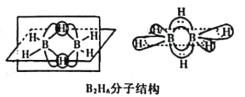
①B2H6分子结构如图,则B原子的杂化方式为____________________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________,写出一种与氨硼烷互为等电子体的分子_________(填分子式)。
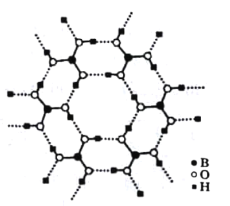
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为_______;硼酸在热水中比在冷水中溶解度显著增大的主要原因是____________。
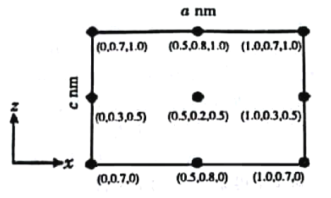
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为anm、bnm和cnm.如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_________;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____g·cm-3(用含字母的代数式表示)。
【答案】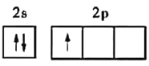 F>N>O>C>B sp3杂化 N C2H6 sp2 升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大 4
F>N>O>C>B sp3杂化 N C2H6 sp2 升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大 4 ![]()
【解析】
(1)B原子核外电子排布式为:1s22s22p1,基态硼原子的价电子排布图是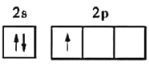 ,同周期第一电离能从左向右逐渐增大,N元素2P3为半充满结构,第一电离能变大,所以,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为F>N>O>C>B。故答案为:
,同周期第一电离能从左向右逐渐增大,N元素2P3为半充满结构,第一电离能变大,所以,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为F>N>O>C>B。故答案为: ;F>N>O>C>B;
;F>N>O>C>B;
(2)①B2H6分子结构如图,B形成4个σ键,价层电子对为4,则B原子的杂化方式为sp3杂化。故答案为:sp3杂化;
②氨硼烷(NH3BH3)分子中存在配位键,提供孤电子对的成键原子是N,B提供空轨道,用价电子迁移法,N与B之间夹着碳元素,与氨硼烷互为等电子体的分子C2H6(填分子式)。故答案为:N;C2H6;
(3)H3BO3晶体为片层结构,B原子最外层有3个电子,与3个-OH形成3个共价键,B的杂化方式为sp2;硼酸在热水中比在冷水中溶解度显著增大的主要原因是:升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大。故答案为:sp2 ;升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大;
(4)原子分数坐标为(0.5,0.2,0.5)的Cs原子位于晶胞体内,原子分数坐标为(0,0.3,0.5)及(1.0,0.3,0.5)的Cs原子分别位于晶胞的左侧面、右侧面上,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的Cs原子分别位于晶胞的上底面、下底面,原子分数坐标为(0,0.7,1.0)及(1.0,0.7,1.0)(0,0.7,0)及(1.0,0.7,0)的Cs原子位于晶胞平行于y轴的棱上,则晶胞中Cs原子数目为:1+4×![]() +4×
+4×![]() =4,由化学式CsSiB3O7,可知晶胞相当于含有4个“CsSiB3O7”,故晶胞质量=4×
=4,由化学式CsSiB3O7,可知晶胞相当于含有4个“CsSiB3O7”,故晶胞质量=4×![]() g,则晶体密度=
g,则晶体密度=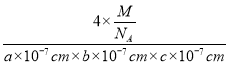 =
=![]() g·cm-3。故答案为:4;
g·cm-3。故答案为:4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】氧化铅-铜电池是一种电解质可循环流动的新型电池(如图所示),电池总反应为![]()
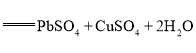 。下列有关该电池的说法正确的是( )
。下列有关该电池的说法正确的是( )
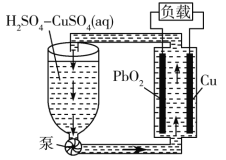
A.电池工作时,电子由Cu电极经电解质溶液流向PbO2电极
B.电池工作过程中,电解质溶液的质量逐渐减小
C.正极反应式:
D.电池工作过程中,两个电极的质量均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第______族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是______(填元素符号、下同)、电负性最小的是______;其中阴离子的空间结构是______,C的杂化方式为______。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
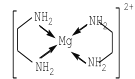
则该环状离子中镁离子的配位数为______。
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:
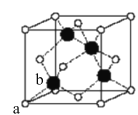
其晶胞棱长为δpm、则其密度为______g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为______pm(用含δ的代数式表示)。a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:______、______。(已知:1m=102cm=1012pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与反应原理设计不一致的是( )
A.热的纯碱溶液清洗油污:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
B.明矾净水:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量) ![]() TiO2xH2O↓+4HCl
TiO2xH2O↓+4HCl
D.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2O![]() Sn(OH)Cl+HCl
Sn(OH)Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶中含有某种活性物质X,其结构简式如图所示。下列关于X的说法错误的是
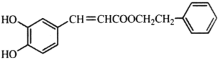
A.分子式为C17H16O4
B.不含手性碳原子,但具有顺反异构现象
C.与溴水既可发生加成反应又可发生取代反应
D.1mol X最多能与8mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的装置示意图如下,下列叙述正确的是
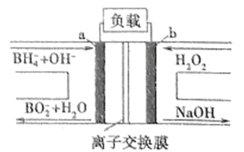
A.b极为正极,发生氧化反应
B.电池应选用阴离子交换膜
C.电子移动方向:电极a→离子交换膜→电极b
D.a极的电极反应式为![]() +8OH--8e-=
+8OH--8e-=![]() +6H2O
+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
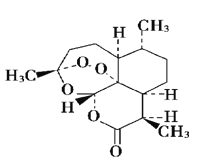
A. C8H10含苯环的烃同分异构体有3种
B. 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物
C. 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
D. 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取, 能够发生水解反应,具有强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com