
【题目】不列离子方程式书写正确的是
A. 铜片与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO2↑+4H2O
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C. 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 用浓氢氧化钠溶液检验溶液中的NH4+:NH4++OH-![]() NH3·H2O
NH3·H2O
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
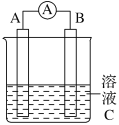
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________;
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为______,B(正极)极材料为________,溶液C为________。
(3)若C为CuCl2溶液,Zn是________极,Cu电极反应为_________________。反应过程溶液中c(Cu2+)________(填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
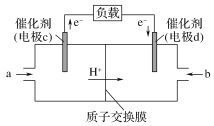
电池总反应为2CH3OH+3O2===2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的反应方程式为________。若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______变成无色,同时有无色气体生成。该反应方程式为:_____________________。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列方程式得出的结论不正确的是
A. C(石墨,s)=C(金刚石,s) △H>0,说明石墨比金刚石稳定
B. NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强
C. 2HCl+CaCO3=CaCl2+CO2↑+H2O,说明盐酸是强酸
D. CH3COO-+H2O![]() CH3COOH+OH-,说明CH3COOH是弱电解质
CH3COOH+OH-,说明CH3COOH是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,发生反应的化学方程式为:____。
(2)由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:___。
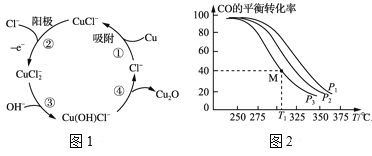
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
①该反应的ΔH___0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是___。
②起始时,容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为___。(保留一位小数)
起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,T1℃下反应达到平衡,CO的平衡转化率____。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
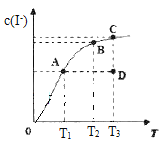
A. 该反应△H<0
B. 若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I3-)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如图:
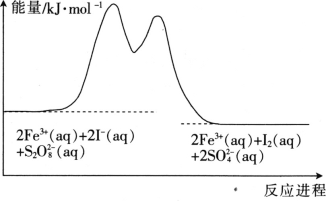
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. Fe2+是该反应的催化剂
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com