
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如图:
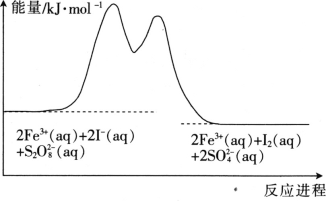
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. Fe2+是该反应的催化剂
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
【答案】A
【解析】
A.由反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)分步进行为:步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq),步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq),由此说明Fe3+为反应的催化剂,所以反应速率与Fe3+浓度有关,故A正确;
B.根据反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)分步进行为:步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq),步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq),由此说明Fe3+为反应的催化剂,故B错误;
C. 由反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)可知:由反应S2O82-~2I-(aq)~I2,则2v(S2O82-)=v(I-)=2v(I2),故C错误;
D. 由图像可知该反应是个放热反应,加催化剂可以同时改变正逆反应的活化能,所以
若不加Fe3+,则正反应的活化能比逆反应的小,故D错误;
所以本题答案:A。


科目:高中化学 来源: 题型:
【题目】不列离子方程式书写正确的是
A. 铜片与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO2↑+4H2O
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C. 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 用浓氢氧化钠溶液检验溶液中的NH4+:NH4++OH-![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由四原子分子构成,它的摩尔质量为Mg/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为___________________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图、下列说法不正确的是
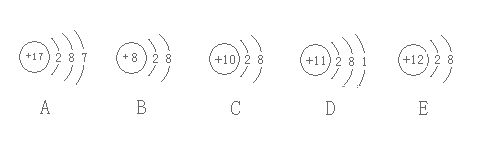
A.B、C、E三种微粒均为稳定结构
B.A与D、B与E均可以形成微粒比为1:1的化合物
C.在0.5mol/LDAB溶液中滴加适量稀盐酸不能增强溶液的漂白能力
D.A与B可以形成A2B7的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
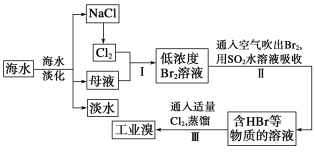
(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是___。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2同时有H2SO4生成,吸收率可达95%,有关反应的离子方程式为___,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com