
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
【答案】C
【解析】
A.相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液,根据影响化学反应速率的因素,增大反应物的浓度,化学反应速率加快,所以②中溶液先褪色,故A错误;
B.向煤炉中灼热的煤炭上洒少量水,发生了C+H2O![]() CO+H2,产物均为可燃性气体,燃烧时产生淡蓝色火焰,根据盖斯定律煤炭放出的热量不会改变,故B错误;
CO+H2,产物均为可燃性气体,燃烧时产生淡蓝色火焰,根据盖斯定律煤炭放出的热量不会改变,故B错误;
C.将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,除去没有反应的溴蒸汽,再通入水中,测所得水溶液的pH<7,说明产生了酸性气体,根据反应原理,苯、液溴在铁粉的作用下发生反应生成溴苯和溴化氢气体,此反应为取代反应,故C正确;
D. 因为Na2SO3与Na2CO3均属于强碱弱酸盐,在溶液中能发生水解显碱性,分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH 后者较大,证明SO32-比CO32-的水解程度小,故D错误;
所以本题答案:C。


科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
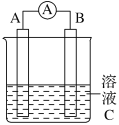
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________;
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为______,B(正极)极材料为________,溶液C为________。
(3)若C为CuCl2溶液,Zn是________极,Cu电极反应为_________________。反应过程溶液中c(Cu2+)________(填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
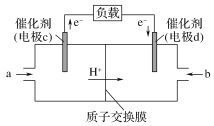
电池总反应为2CH3OH+3O2===2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的反应方程式为________。若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
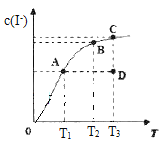
A. 该反应△H<0
B. 若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I3-)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为___________。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O2+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于__________晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为___________。
(3)Co3+与NO2―形成的配合物与K+生成黄色沉淀检验溶液中的K+。配体NO2―的立体构型为__________,某常见气体化合物为NO2―的等电子体,该化合物的分子式为__________。
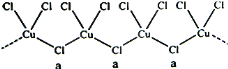
(4)氯和钾与+2价的铜可生成一种催化乙炔聚合反应的化合物,其阴离子为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为________杂化,这种化合物的化学式为_________
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_____。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_____g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是

A. 到平衡后,加入催化剂则C%增大
B. 化学方程式中n<e+f
C. 达到平衡后,若升温,平衡左移
D. 达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)28g氮气含有的质子数为____________个。
(2)9.03×1023个H2O分子所含氧原子数与_________gCO2中所含氧原子数相等。
(3)在一定温度和压强下,10mL气体A2跟15mL的气体B2完全化合生成气体A2B3,则该气体在相同条件下的体积为_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如图:
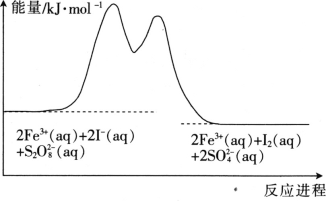
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. Fe2+是该反应的催化剂
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 的名称是_____________________。
的名称是_____________________。
(2)C5H12的某种同分异构体只有一种一氯代物,写出它的结构简式_____________。
(3)某芳香烃结构为![]() ,其一氯代物有_________种。
,其一氯代物有_________种。
(4)写出由2-溴丙烷和必要的无机试剂制取1,2-丙二醇的化学反应方程式(有几步就写几个方程式):____________________。
(5)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子链端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6:1:1。
①A的分子式为___________,A的结构简式为_____________。
②有机物B是A的同分异构体,1 mol B 可与1 mol Br2加成,该有机物中所有碳原子在同一个平面上,没有顺反异构现象,B的结构简式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com