
【题目】(1)键线式![]() 的名称是_____________________。
的名称是_____________________。
(2)C5H12的某种同分异构体只有一种一氯代物,写出它的结构简式_____________。
(3)某芳香烃结构为![]() ,其一氯代物有_________种。
,其一氯代物有_________种。
(4)写出由2-溴丙烷和必要的无机试剂制取1,2-丙二醇的化学反应方程式(有几步就写几个方程式):____________________。
(5)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子链端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6:1:1。
①A的分子式为___________,A的结构简式为_____________。
②有机物B是A的同分异构体,1 mol B 可与1 mol Br2加成,该有机物中所有碳原子在同一个平面上,没有顺反异构现象,B的结构简式是_______________。
【答案】2-甲基戊烷 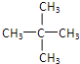 4 CH3CHBrCH3+NaOH
4 CH3CHBrCH3+NaOH![]() CH2═CHCH3+NaBr+H2O、CH2═CHCH3+Br2→CH2BrCHBrCH3、CH2BrCHBrCH3+2NaOH
CH2═CHCH3+NaBr+H2O、CH2═CHCH3+Br2→CH2BrCHBrCH3、CH2BrCHBrCH3+2NaOH![]() CH2OHCHOHCH3+2NaBr C5H8O
CH2OHCHOHCH3+2NaBr C5H8O 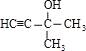 (CH3)2C=CHCHO
(CH3)2C=CHCHO
【解析】
(1)![]() 分子中含有6个碳原子,属于饱和烃,分子式为C6H14,依据烷烃的命名原则命名,依据键线式书写结构简式即可;
分子中含有6个碳原子,属于饱和烃,分子式为C6H14,依据烷烃的命名原则命名,依据键线式书写结构简式即可;
(2)先书写C5H12的同分异构体,然后根据一氯取代物的种类等于氢原子的种类写出结构简式;
(3)根据等效氢分析判断![]() 中氢原子的种类,再判断一氯代物的数目;
中氢原子的种类,再判断一氯代物的数目;
(4)CH3CHBrCH3为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH,-Br变化为两个-OH,可以应先消去生成C=C,再加成引入两个卤素原子,最后水解即可;
(5)①有机物A只含有C、H、O三种元素,根据题意计算出C和H的物质的量,以及有机物A的物质的量,判断A中C、H原子数,再根据相对分子质量计算氧原子数,最后确定A的分子式;结合红外光谱分析和核磁共振氢谱和A的分子式书写A的结构简式;
②有机物B是A的同分异构体,1molB可与1molBr2加成,说明分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,以碳碳双键确定的平面,结合A的分子式分析判断B中含有的基团,再结合没有顺反异构现象确定B的结构简式。
(1)![]() 分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C上有一个甲基,结构简式为:(CH3)2CHCH2CH2CH3,命名为:2-甲基戊烷,故答案为:2-甲基戊烷;
分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C上有一个甲基,结构简式为:(CH3)2CHCH2CH2CH3,命名为:2-甲基戊烷,故答案为:2-甲基戊烷;
(2) C5H12的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、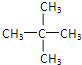 ;其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,为
;其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,为 ,故答案为:
,故答案为: ;
;
(3)根据等效氢法:①同一碳原子上的氢原子等效;②同一碳原子上所连-CH3上的氢原子等效;③处于对称位置上的碳原子上的氢原子等效;![]() 有4类氢原子(
有4类氢原子(![]() ),因此有四种一氯代物,故答案为:4;
),因此有四种一氯代物,故答案为:4;
(4)CH3CHBrCH3为主要原料制取1,2-丙二醇CH3CH(OH)CH2OH。
①先发生溴代烃的消去反应生成C=C,方程式为:CH3CHBrCH3+NaOH![]() CH2═CHCH3+NaBr+H2O;
CH2═CHCH3+NaBr+H2O;
②再发生丙烯的加成反应引入两个卤素原子,方程式为:CH2═CHCH3+Br2→CH2BrCHBrCH3;
③最后发生卤代烃的水解反应生成CH3/span>CH(OH)CH2OH,方程式为:CH2BrCHBrCH3+2NaOH![]() CH2OHCHOHCH3+2NaBr,
CH2OHCHOHCH3+2NaBr,
故答案为:CH3CHBrCH3+NaOH![]() CH2═CHCH3+NaBr+H2O、CH2═CHCH3+Br2→CH2BrCHBrCH3、CH2BrCHBrCH3+2NaOH
CH2═CHCH3+NaBr+H2O、CH2═CHCH3+Br2→CH2BrCHBrCH3、CH2BrCHBrCH3+2NaOH![]() CH2OHCHOHCH3+2NaBr;
CH2OHCHOHCH3+2NaBr;
(5)①有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量为0.2mol,经燃烧生成44.0gCO2,物质的量为![]() =1mol,生成14.4gH2O,物质的量为
=1mol,生成14.4gH2O,物质的量为![]() =0.8mol,故有机物A中C原子数目为
=0.8mol,故有机物A中C原子数目为![]() =5,H原子数目为
=5,H原子数目为![]() =8,故氧原子数目为
=8,故氧原子数目为![]() =1,故A的分子式为C5H8O;不饱和度为
=1,故A的分子式为C5H8O;不饱和度为![]() =2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6∶1∶1,故分子中含有2个CH3、1个-OH连接在同一C原子上,故A的结构简式为
=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6∶1∶1,故分子中含有2个CH3、1个-OH连接在同一C原子上,故A的结构简式为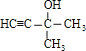 ,故答案为:C5H8O;
,故答案为:C5H8O; ;
;
②有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式可知,B中还含有-CHO,故B为(CH3)2C=CHCHO,故答案为:(CH3)2C=CHCHO。


科目:高中化学 来源: 题型:
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式____。
(2)①写出实验室中由固体物质制取氨气的化学方程式__;
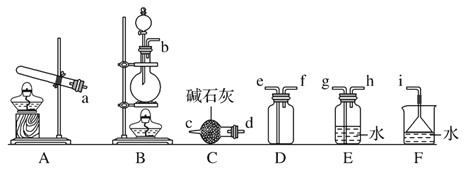
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)
(3)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
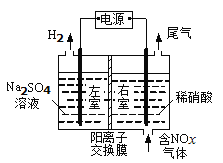
①写出电解时NO2发生反应的电极反应式:___。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
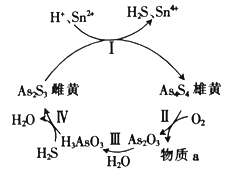
【题目】As和P属于同主族元素,它们都能形成多种含氧酸。中国自古就有“信口雌黄”“雄黄入药”之说。雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。在一定条件下,雌黄和雄黄的转化关系如图所示。
(1)亚磷酸(H3PO3)是一种精细化工产品。亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3。
①则亚磷酸为___(填“一”“二”或“三”)元酸。
②查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7,Na2HPO3可使碘水褪色,25℃时,Na2HPO3水解反应的Kh=____,若向Na2HPO3溶液中加入少量的I2,则溶液中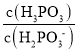 将__(填“增大”、“减小”或“不变”)
将__(填“增大”、“减小”或“不变”)
(2)反应II中,若0.5molAs4S4参加反应,转移14 mol电子,则物质a为__(填化学式)
(3)反应Ⅲ中的产物亚砷酸H3AsO3可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
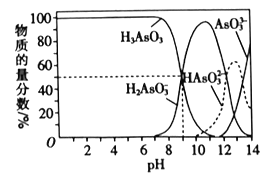
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷的某种合成原料由C、H、O三种元亲组成,其球棍模型如图所示。

下列说法正确的是
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与 NaHCO3反应放出CO2的只有3种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
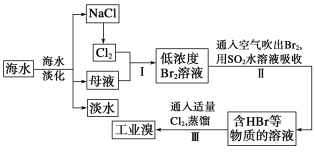
(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是___。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2同时有H2SO4生成,吸收率可达95%,有关反应的离子方程式为___,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3+氧化性强于Cu2+,向含有![]() 、
、 ![]() 的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断错误的是( )
的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断错误的是( )
A.加入KSCN溶液不显红色
B.溶液中一定含Fe2+
C.溶液中一定含 ![]()
D.剩余固体中一定含铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是石油裂解气的重要成分,由M制备环酯P的合成路线(部分反应条件略去)如图所示:
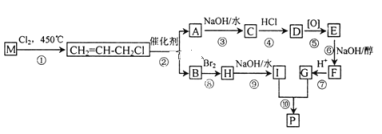
已知在特殊催化剂的作用下,能够发生碳碳双键两边基团互换的反应,如:
2CH2=CHR![]() CH2=CH2+RCH=CHR
CH2=CH2+RCH=CHR
回答下列问题:
(1)M的名称是____________。
(2)⑥的反应类型是________________。
(3)C的结构简式为____________。由C→G的过程中步骤④、⑥的目的是___________。
(4)符合下列条件D的同分异构体有______种。
①氯原子连在碳链的端点碳上 ②羟基连在不同的碳原子上
(5)由I和G在一定条件下制取环酯P的化学方程式为_________________。
(6)已知: 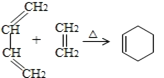 根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com