
����Ŀ��M��ʯ���ѽ�������Ҫ�ɷ֣���M�Ʊ�����P�ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��
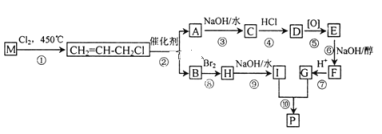
��֪����������������£��ܹ�����̼̼˫�������Ż����ķ�Ӧ���磺
2CH2=CHR![]() CH2=CH2+RCH=CHR
CH2=CH2+RCH=CHR
�ش��������⣺
(1)M��������____________��
(2)�ķ�Ӧ������________________��
(3)C�Ľṹ��ʽΪ____________����C��G�Ĺ����в���ܡ���Ŀ����___________��
(4)������������D��ͬ���칹����______�֡�
����ԭ������̼���Ķ˵�̼�� ���ǻ����ڲ�ͬ��̼ԭ����
(5)��I��G��һ����������ȡ����P�Ļ�ѧ����ʽΪ_________________��
(6)��֪�� 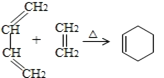 ����������Ϣ�������2-�ȱ����Ʊ�����ϩ�ĺϳ�·��(���Լ����ܼ���ѡ)___________��
����������Ϣ�������2-�ȱ����Ʊ�����ϩ�ĺϳ�·��(���Լ����ܼ���ѡ)___________��
���𰸡���ϩ ��ȥ��Ӧ HOCH2-CH=CH-CH2OH ����������̼̼˫���������� 10 HOOCCH=CHCOOH+HOCH2CH2OH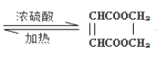 +2H2O CH3-CHCl-CH3
+2H2O CH3-CHCl-CH3![]() CH2=CH-CH3
CH2=CH-CH3![]() CH2=CH2��CH3-CH=CH-CH3
CH2=CH2��CH3-CH=CH-CH3![]() CH3-CHBr-CHBr-CH3
CH3-CHBr-CHBr-CH3![]() CH2=CH-CH=CH2
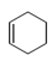
CH2=CH-CH=CH2![]()
��������
M��ʯ���ѽ�������Ҫ�ɷ֣�����������ȡ����Ӧ����CH2=CHCH2Cl����MΪCH2=CHCH3���ɷ�Ӧ��Ϣ��֪��CH2=CHCH2Cl�ڴ�������������CH2=CH2��ClCH2CH=CHCH2Cl��A����������ˮ��Һ�����������·�����Ӧ����AΪClCH2CH=CHCH2Cl��BΪCH2=CH2��B���巢���ӳɷ�Ӧ����HΪBrCH2CH2Br��H����������ˮ��Һ�����������·���ȡ����Ӧ����IΪHOCH2-CH2OH��A����������ˮ��Һ�����������·�����Ӧ����CΪHOCH2CH=CHCH2OH��C����D��C��HCl�ļӳɷ�Ӧ����DΪHOCH2CH2CHClCH2OH��D����������Ӧ����E��E������ȥ��Ӧ����F��F�ữ�õ�G����G��I����������Ӧ���ɻ���P����EΪ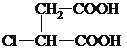 ��FΪNaOOC-CH=CH-COONa��GΪHOOC-CH=CH-COOH��PΪ
��FΪNaOOC-CH=CH-COONa��GΪHOOC-CH=CH-COOH��PΪ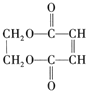 ��
��
(6)��2-�ȱ����ڴ��������µõ�CH2=CH2��CH3-CH=CH-CH3��CH3-CH=CH-CH3����ˮ�����ӳɷ�Ӧ�õ�CH3-CHBr-CHBr-CH3��Ȼ������ȥ��Ӧ�õ�CH2=CHCH=CH2����ϩ��CH2=CHCH=CH2�����ӳɷ�Ӧ�õ�����ϩ��
(1)MΪCH2=CHCH3��M�������DZ�ϩ��
(2)�ķ�Ӧ��������ȥ��Ӧ��
(3)C�Ľṹ��ʽΪHOCH2CH=CHCH2OH����C��G�Ĺ����в���ܡ���Ŀ���ǣ�����������̼̼˫������������
(4)DΪHOCH2CH2CHClCH2OH��D��ͬ���칹����Clԭ��λ�ڶ�ͷ̼ԭ���ϣ����ǻ����ڲ�ͬ��̼ԭ���ϵ���ClCH2CH(OH)CH2CH2OH��ClCH2CH2CH(OH)CH2OH��ClCH(OH)CH2CH2CH2OH��ClCH2CH(OH)CH(OH)CH3��ClCH(OH)CH2CH(OH)CH3��ClCH(OH)CH(OH)CH2CH3��ClCH(OH)C(CH3)2OH��ClCH(OH)CH(CH3)CH2OH��ClCH2C(OH)(CH3)CH2OH��ClCH2CH(CH2OH)2����10�֣�
(5)��I��G��һ����������ȡ����P�Ļ�ѧ����ʽΪ��![]() ��
��
(6)��2-�ȱ����ڴ��������µõ�CH2=CH2��CH3-CH=CH-CH3��CH3-CH=CH-CH3����ˮ�����ӳɷ�Ӧ�õ�CH3-CHBr-CHBr-CH3��Ȼ������ȥ��Ӧ�õ�CH2=CHCH=CH2����ϩ��CH2=CHCH=CH2�����ӳɷ�Ӧ�õ�����ϩ���ϳ�·������ͼΪ��CH3-CHCl-CH3![]() CH2=CH-CH3
CH2=CH-CH3![]() CH2=CH2��CH3-CH=CH-CH3
CH2=CH2��CH3-CH=CH-CH3![]() CH3-CHBr-CHBr-CH3
CH3-CHBr-CHBr-CH3![]() CH2=CH-CH=CH2
CH2=CH-CH=CH2![]()
 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
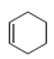
����Ŀ��(1)����ʽ![]() ��������_____________________��
��������_____________________��
(2)C5H12��ij��ͬ���칹��ֻ��һ��һ�ȴ��д�����Ľṹ��ʽ_____________��
(3)ij�������ṹΪ![]() ����һ�ȴ�����_________�֡�
����һ�ȴ�����_________�֡�
(4)д����2-�����ͱ�Ҫ�����Լ���ȡ1��2-�������Ļ�ѧ��Ӧ����ʽ(�м�����д��������ʽ)��____________________��
(5)�л���Aֻ����C��H��O����Ԫ�أ��������л��ϳɵ��м��塣16.8g���л���ȼ������44.0 g CO2��14.4 g H2O������ͼ��������Է�������Ϊ84���������������A�����к���O��H����λ�ڷ������˵�C��C�����˴Ź����������������壬�����֮��Ϊ6:1:1��
��A�ķ���ʽΪ___________��A�Ľṹ��ʽΪ_____________��
���л���B��A��ͬ���칹�壬1 mol B ����1 mol Br2�ӳɣ����л���������̼ԭ����ͬһ��ƽ���ϣ�û��˳���칹����B�Ľṹ��ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ���з���һ�������¡��ɺ�������Na��CO2���ε�ء���NaClO4�����л��ܼ���Ϊ���Һ���ƺ���̼���ܵ������ֱ���Ϊ�缫���ϣ���ص��ܷ�ӦΪ��3CO2+4Na![]() 2Na2CO3+C������˵���������
2Na2CO3+C������˵���������

A. �ŵ�ʱ��ClO4�����ƶ�
B. ���ʱ�ͷ�CO2���ŵ�ʱ����CO2
C. �ŵ�ʱ��������ӦΪ��3CO2+4e ��2CO32��+C
D. ���ʱ��������ӦΪ��Na++e��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ��ɫ���壬��ṹ��ͼ��ʾ�������й�˵������ȷ���ǣ� ��
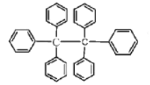
A. ����һ�ֱ���ͬϵ��������л��ܼ���
B. ���ķ���ʽΪC38H30��ֻ���зǼ��Լ�
C. �˴Ź���������3���
D. ���ķ���������ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦMnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2��������˵����ȷ����( )
MnCl2��2H2O��Cl2��������˵����ȷ����( )
A.MnO2�ǻ�ԭ��
B.HCl ��������
C.������7.1gCl2����ת��0.1 mol����
D.������7.1gCl2������������������ʵ�����0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ��������ʵ�飬�������ǣ� ��
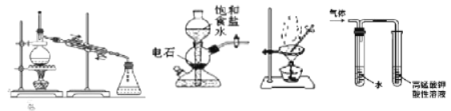
A. �ᴿ��ҵ�Ҵ������״���ˮ�����ʣ���װ�â�
B. ʵ�����������Ʊ��϶�������Ȳ����װ�â�
C. �ᴿ�������������ʵĴֱ�����ѡ��װ�â�
D. ������������NaOH�Ҵ���Һ�����Ƶõ�����ѡ��װ�â�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��CO(NH2)2(s)+H2O(1)2HN3(g)+CO2(g)��H=+133.6kJ/mol�����ڸ÷�Ӧ������˵����ȷ����____________������ţ���
a.�ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b.��ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c.�����¶ȿ�ʹ���ص�ת��������
d.�ﵽƽ�����С�����������ƽ�����淴Ӧ�����ƶ����ﵽƽ��ʱNH3��Ũ�ȴ���ԭƽ��
��������һ�������¿ɽ����������ﻹԭΪ������
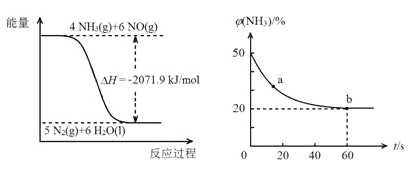
��֪��
�ٽ�Ϣ��е���Ϣ����Ӧ2CO(NH2)2(s)+6NO(g)5N2(g)+2CO2(g)+4H2O(1)�Ħ�H=______kJ/mol��
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ�ϣ���120�桢����������Ӧ�������أ�CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g)�����������NH3�����ʵ����ٷֺ�����ʱ��仯��ϵ��ͼ��ʾ��������ƽ��ת����Ϊ____________
��2��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2����֪9.2gNO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol��ǡ�÷�Ӧ��ʹ��Һ�е�CԪ��ȫ����CO2��ʽ�ݳ���������Һ�������ԣ�����Һ������Ũ�ȴ�С��ϵ��c(Na+)��_________________________��
��3������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH��Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��
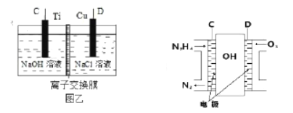
����װ����������ӦʽΪ_________________________���õ����е����ӽ���ĤΪ______________������������������ӽ���Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ�����ĩ����֪���˺��� KNO3 ���������п��ܻ����� KCl��Ba(NO3)2��CuSO4��K2CO3��Na2SO4 �е�һ�ֻ�������ͨ������ʵ����ȷ������Ʒ�������
�������ַ�ĩ����ˮ���������а�ɫ������������������Һ����ɫ��
�������ij������м�������ϡ������������ȫ�ܽ⣬�������ݲ�����
��ȡ����������Һ������ϡ�������а�ɫ����������
����ȡ���й��˺����Һ�������� AgNO3 ��Һ��������ɫ������ ��������ʵ����ʵ���ش��������⣺
��1��ԭ��ɫ��ĩ�г� KNO3 ����һ�������е�������_________��һ�������е����� ��_____�����ܴ��ڵ�������_____(�ѧʽ)��
��2����д���������仯�����漰�Ļ�ѧ��Ӧ����ʽ��_____��
��3��A ͬѧΪ��ȷ�ϸù����ĩ�������ܴ��ڵ��������Ƿ���ڣ� ������ȡ����������Ʒ���Թ��м�����������ˮ�ܽ�������ݸ�ͬѧ��Ƶķ��������
![]()
������Լ���_________�Լ���_____(�ѧʽ)���������Լ���ʱ��ʵ���� ��Ϊ_____�Ϳ���ȷ�ϸ�����һ��������
��4��B ͬѧΪ�˽�һ��ȷ������Ʒ�ijɷ�������ȡ�� 10.0 g �ù����������·�������ʵ���� ˵����ʵ���в����������Ѿ�����ɱ�״���µ������
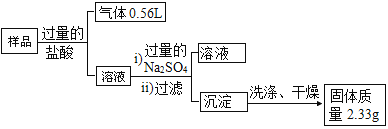
���������ʵ���ҽ�������ʵ�����ʱ���ϴ�ӳ���_____��
�������� B ͬѧ����ʵ�鷽�������������Һ 2���е����ʽ�һ��������ͨ�����е�ʵ�����ݷ��������� ��Ʒ�к� KNO3 ����������Ϊ_____ʱ������ȷ����Ʒ��һ�������������ܴ��ڵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ȡ��ˮ�Ȼ�ͭ��ʵ��װ��ͼ����Aװ���н�Ũ����μӵ�ʢ�ж������̷�ĩ��Բ����ƿ�У���ƿ�з�����Ӧ��ԭ��Ϊ��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
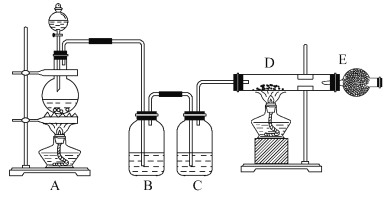
��ش��������⣺
(1)װ����ʢ��Ũ�������������Ϊ_______��
(2)Bƿ���Լ��������dz�ȥ�����к��е��Ȼ������壬Cƿ���Լ���������______��
(3)������D�еķ�Ӧ����ʽ��________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com