
����Ŀ�����¶���ͬ���ݻ���Ϊ2 L��3�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��£���÷�Ӧ�ﵽƽ��ʱ���й��������¡�����˵����ȷ����
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 1mo N2��3mol H2 | 2mol N2��6mol H2 | 2mol NH3 |
NH3Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
��Ӧ�������仯 | �ų�Q1kJ | �ų�Q2kJ | ����Q3kJ |
��ϵѹǿ��Pa�� | p1 | p2 | p3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
��֪N2(g)��3H2(g)![]() 2NH3(g)����H����92.4 kJ��mol��1
2NH3(g)����H����92.4 kJ��mol��1
A. 2p1��2p3��p2 B. �ﵽƽ��ʱ��������NH3������������
C. ��2����3��1 D. Q1��Q3��92.4
���𰸡�D
��������
��Ͷ��1molN2��3molH2��������Ͷ����2molNH3�����º��������£���������������ǵ�Чƽ�⣬����ֵ����ʵ�����������ת���ʵ���ȫ��ȣ���������Ͷ��1molN2��3molH2������������2molN2��6molH2�����м������Ǽ��еĶ���������������������ݻ��Ǽ�����2�������������������Ϊ��Чƽ�⣬�������������ƽ�⣬���Կ����ں������ݻ��Ǽ��������������£�����ƽ�����ѹ�����Ϊ��������������������ƽ�⣬���ڸ÷�Ӧ�������С�ķ�Ӧ����С���������������ѹǿ��ƽ�����������ƶ����������е���������ת���ʴ��ڼģ�ƽ������а���������ݴ��жϡ�
A����������Ӧ��Ͷ����2molNH3���ͼ���ʼ����ͬ���ͱ�ƽ��״̬��ͬ������ѹǿΪ�Ķ��������������൱������ѹǿ��ƽ�����������ƶ�����������ѹǿ��С��С�ڼ�2������2p1��2p3��p2��A����
B����������Ӧ��Ͷ����2molNH3�����ü���ת����ת��Ϊ��Ӧ��Ϊ1molN2��3molH2���ͼ��е���ͬ������������2molN2��6molH2�����м������Ǽ��еĶ��������������ƽ�⣬���Կ����ں������ݻ��Ǽ��������������£�����ƽ�����ѹ�����Ϊ��������������������ƽ�⣬���ڸ÷�Ӧ�������С�ķ�Ӧ����С���������������ѹǿ��ƽ�����������ƶ����������е���������ת���ʴ��ڼģ�ƽ������а����������B����
C���������м���2molNH3���ͼ����ﵽ��ͬ��ƽ��״̬����ƽ�ⲻ�ƶ���ת������1+��3=1����������Ӧ��Ͷ����2mol N2��6mol H2�����������൱������ѹǿ��ƽ�����������ƶ���������ת������������ת������2+��3��1��C����
D����Ͷ��1molN2��3molH2������Ͷ��2molNH3�������������ȫ��Ч�ģ����ݸ�˹���ɿ�֪�������ҵķ�Ӧ�������仯֮��Ϊ92.4kJ����Q1+Q3=92.4��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ú������ʣ�FeO��Fe2O3���ķ�CuO�Ʊ��������壬���������й��̣���֪ Fe3+�� pH=5ʱ������ȫ�������з����������

A. ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O
B. ����ڲ�������ˮ�������ǿ����������H2O2
C. ������� CuCO3����CuOҲ�ɵ�����Һ��pH
D. �����Ϊ���ˣ�����������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
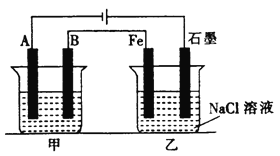
����Ŀ������ͼ��ʾ���ס���Ϊ������������ء�
�Իش�
��1���ҳ���Fe�缫Ϊ____________���������ҳ��е���������̪��Һ����ʼ���һ��ʱ������缫������_____________ɫ��
��2���׳���Ϊ����ͭ�������ͭ������Ǿ��ȵģ������л��úͲ����õijɷݾ����ڣ���װ�ã���������Һ������________________��ͨ��һ��ʱ���A�缫����12.8g�����ҳ�ʯī�缫�ų��������ڱ�״���µ����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ����Ԫ��ԭ�ӵĺ˵����������ԭ�Ӻ�������������������
A.8B.19C.16D.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�

���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������20 mL 0.01 mol��L��1 HNO2(����)��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵������ȷ����

A. HNO2�ĵ���ƽ�ⳣ����c��>b��
B. b������Һ�����ԣ�c(Na��)>c(NO2-)>c(H��)>c(OH��)
C. c������Һ�У�c(OH��)>c(HNO2)
D. d������Һ�У�c(Na��)>c(OH��)>c(NO2-)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��������γɹ⻯ѧ��������Ϊ����ɫ�̼�����ζ���ж�������( )
A.CO2B.SO2C.N2D.NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L�ĺ����ܱ������г���6molCO2 ��8molH2��������ӦCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= -49.0kJmol-1�����n(H2)��ʱ��ı仯�����ߢ���ʾ������˵����ȷ����
CH3OH(g)+H2O(g) ��H= -49.0kJmol-1�����n(H2)��ʱ��ı仯�����ߢ���ʾ������˵����ȷ����
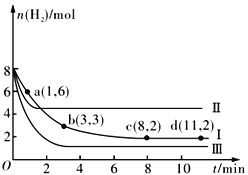
A. �÷�Ӧ��0~8 min��CO2 ��ƽ����Ӧ������0.375mol��L-1��min-1
B. �����¶Ȳ��䣬����ʼʱ�����������г���4molCO2��2molH2��2molCH3OH(g)��1mol H2O(g)�����ʱ��Ӧ������Ӧ�������
C. �����¶Ȳ��䣬����ʼʱ�����������г���3molCO2 ��4molH2����ƽ��ʱH2 �������������20%
D. �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ���ж������Ȼ�ѧ����ʽ��д����ȷ����( )
A. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=-91.5 kJ/mol
HCl(g)��H=-91.5 kJ/mol
B. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=+91.5 kJ/mol
HCl(g)��H=+91.5 kJ/mol
C. H2(g)+Cl2(g)![]() 2HCl(g) ��H=-183 kJ/mol
2HCl(g) ��H=-183 kJ/mol
D. 2HCl(g)![]() H2(g)+Cl2(g) ��H=+183kJ/mol
H2(g)+Cl2(g) ��H=+183kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com