
【题目】如下图所示,甲、乙为相互串联的两电解池。
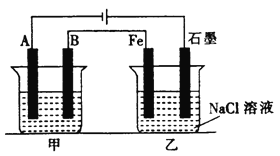
试回答:
(1)乙池中Fe电极为____________极。若在乙池中滴入少量酚酞试液,开始电解一段时间后,铁电极附近呈_____________色。
(2)甲池若为精炼铜(假设粗铜的组成是均匀的,且其中活泼和不活泼的成份均存在)的装置,则电解质溶液可以是________________;通过一段时间后,A电极增重12.8g,则乙池石墨电极放出的气体在标准状况下的体积为_____________。
【答案】阴红CuSO4溶液4.48L
【解析】
根据电解池的电极与外接电源的关系,可知A为阴极,B为阳极,Fe为阴极,石墨为阳极,结合电解池的工作原理和电解规律分析可得结论。
(1)乙池中Fe极电极反应式为2H++2e-=H2↑,在乙池中滴入少量酚酞试液,开始电解一段时间,由于水提供的H+在阴极(Fe)放电,OH-浓度增大,溶液呈碱性,铁极附近呈红色,故答案为:阴、红;
(2)若甲为精炼铜的装置,则电解质溶液用含Cu2+的溶液,如CuSO4溶液;A极上Cu2+放电,电极反应式为:Cu2++2e-=Cu,当A电极增重12.8g时,转移电子的物质的量为:12.8g÷64g/mol×2=0.4mol,根据电子守恒可知乙池中石墨电极氯离子放电产生氯气为:0.4mol÷2=0.2mol,体积为:0.2mol×22.4L/mol=4.48L,故答案为:CuSO4溶液、4.48L。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合。达到平衡后溶液呈红色。再将混合液等分为5份,分别进行如下实验:
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol·L-1 KCl溶液,振荡 | |
实验④:滴加4滴1 mol·L-1 KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol·L-1 NaOH溶液,振荡 |
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加生成物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项 | X | Y | Z | 对应过程的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①Na2CO3熔融 |
B | NaOH | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
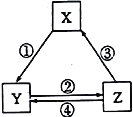
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量:________________________________________________________________________
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是含碳元素的物质:①石墨,②一氧化碳,③干冰,④碳酸,⑤碳酸钙,⑥乙醇。其中属于单质的是______(填序号,下同);属于酸性氧化物的是______;属于盐的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,M的L层电子数为K层和M层电子数之和,D和M同主族。回答下列问题:
(1)元素B的符号和名称分别是____,______;在周期表中的位置是_________________。
(2)元素C的原子结构示意图为______________________________。
(3)元素C与M可形成CM2,C与N可形成CN4,这两种化合物均可做溶剂,其电子式分别为:________________和____________________。
(4)元素A与D、E形成10电子分子的结构式分别为:_______________和 _________________。
(5)元素D和M相比,非金属性较强的是_____________(用元素符号表示)。
(6)元素D、M的氢化物的沸点高低顺序为:______________________(用化学式表示)。
(7)在一定条件下,A、D的单质和M的最高价氧化物对应水化物的溶液可构成原电池,该电池在放电过程中,电解质溶液的酸性将_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com