
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
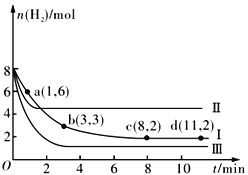
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
【答案】B
【解析】A. 由图中曲线I可知,该反应在0~8min内氢气的变化量为6mol,则二氧化碳的变化量为2mol,该反应在0~8min内CO2的平均反应速率是![]() mol·L-1·min-1,A不正确;B. 由图中曲线I可知,该反应在8min达到平衡,反应混合物中有4molCO2、2molH2、2molCH3OH(g)和2molH2O(g)。保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1molH2O(g),相当于在原平衡状态减少1mol H2O(g),则此时反应向正反应方向进行,B正确;C. 原平衡混合物中H2的体积分数等于20%。保持温度不变,若起始时向上述容器中充入3molCO2和4molH2,相当于对原平衡减压,平衡向逆向移动,则平衡时H2的体积分数大于20%,C不正确;D. 该反应为放热反应。改变条件后,化学反应速率都加快了,但是II的平衡向左移动、III的平衡向右移动,所以曲线Ⅱ改变的条件是升高温度、曲线Ⅲ改变的条件是升增大压强,D不正确。本题选B。
mol·L-1·min-1,A不正确;B. 由图中曲线I可知,该反应在8min达到平衡,反应混合物中有4molCO2、2molH2、2molCH3OH(g)和2molH2O(g)。保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1molH2O(g),相当于在原平衡状态减少1mol H2O(g),则此时反应向正反应方向进行,B正确;C. 原平衡混合物中H2的体积分数等于20%。保持温度不变,若起始时向上述容器中充入3molCO2和4molH2,相当于对原平衡减压,平衡向逆向移动,则平衡时H2的体积分数大于20%,C不正确;D. 该反应为放热反应。改变条件后,化学反应速率都加快了,但是II的平衡向左移动、III的平衡向右移动,所以曲线Ⅱ改变的条件是升高温度、曲线Ⅲ改变的条件是升增大压强,D不正确。本题选B。


科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
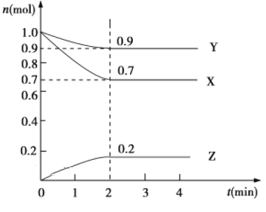
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是人类日常生活中必不可少的营养物质,油脂的主要成分是高级脂肪酸甘油酯。常见的高级脂肪酸有硬脂酸、软脂酸、油酸和亚油酸四种,现将这四种酸与甘油混合加热,生成混甘油酯的种类有(不考虑立体异构)(已知:结构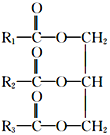 中,R1、R2、R3相同的为单甘油酯,R1、R2、R3不完全相同的为混甘油酯)
中,R1、R2、R3相同的为单甘油酯,R1、R2、R3不完全相同的为混甘油酯)
A. 28种 B. 32种 C. 36种 D. 40种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
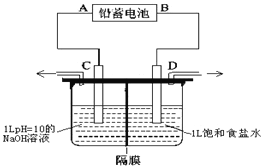
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系按由大到小排序
A.体积大小:___________________ B.质量大小:________________
C.密度大小:___________________D.原子数目:_________________
(2)标准状况下,33.6 L的HCl所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(3)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________
(4)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_________
(5)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl的物质的量浓度为________
(6)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等
相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为___________
在0℃和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是________L
若1gN2含a个原子,则阿伏加德罗常数可表示为_____________
由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO![]() )= 0.6 mol/L,则c(K+)为________
)= 0.6 mol/L,则c(K+)为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为不同化学元素组成的化合物示意图,以下说法正确的是( )
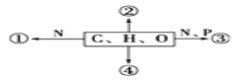
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②大量积累于皮下和内脏器官周围,则②是磷脂
C. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
D. 若③为生物大分子,则一定被甲基绿染成绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法的原理是将二氧化碳通入到溶有氨气的饱和食盐水中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的NaHCO3,实验包括:制取氨气-制取NaHCO3-分离NaHCO3-干燥NaHCO3四个步骤。下列实验选用的主要仪器不正确的是

A. 制取氨气,选用②③ B. 制取NaHCO3,选用⑨
C. 分离NaHCO3,选用④⑤⑦ D. 干燥NaHCO3,选用①⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com