
【题目】现有mg某气体,它由四原子分子构成,它的摩尔质量为Mg/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为___________________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol/L。
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______变成无色,同时有无色气体生成。该反应方程式为:_____________________。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
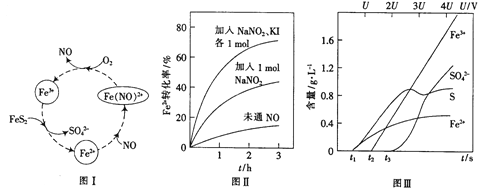
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是

A. 到平衡后,加入催化剂则C%增大
B. 化学方程式中n<e+f
C. 达到平衡后,若升温,平衡左移
D. 达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是______________(填序号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学反应方程式:________________。
(3)怎样证明制得的物质是胶体?请简述操作过程:__________________。
(4)取少量制得的胶体加入试管中,再加入少量(NH4)2SO4溶液,观察到的现象是__________, 这种现象称为胶体的________________。
(5)Fe(OH)3胶体能稳定存在的主要原因是________(填序号)。
A. 胶粒直径小于1nm B. 胶粒带正电荷
C. 胶粒作布朗运动 D . 胶粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________(填序号)。
A. Fe(OH)3胶体粒子的直径在1~100nm之间
B. Fe(OH)3胶体具有丁达尔效应
C. Fe(OH)3胶体是均一的分散系
D. Fe(OH)3胶体的分散质粒子能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如图:
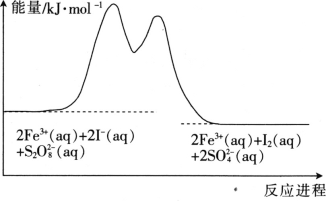
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. Fe2+是该反应的催化剂
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以利用如图所示装置制备氯气,回答下列问题:
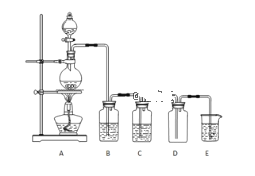
(1)分液漏斗中为浓盐酸,烧瓶中是二氧化锰固体,写出制取氯气的化学方程式___。
(2)E中发生的化学反应方程式___。
(3)B中盛放的试剂是___。
(4)C中试剂的作用___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
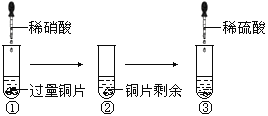
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)13.8g氮的氧化物(NOx)中含N原子数为0.3mol,则NOx的摩尔质量为___,x的数值为___,该质量的NOx在标准状况下的体积为___L。
(2)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:① 加入过量的稀盐酸,有白色沉淀生成;② 过滤,得无色透明溶液,在滤液中加入过量的稀硫酸,又有白色沉淀生成;③ 过滤,取少量滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有___离子;—定不含有__离子;还有____离子不能确定是否存在,要检验这些离子的实验方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com