
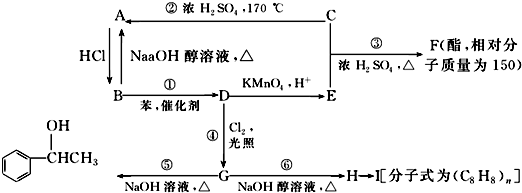
 ��
�� ��
�� ��
��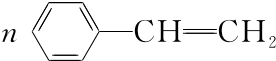 $\stackrel{����}{��}$
$\stackrel{����}{��}$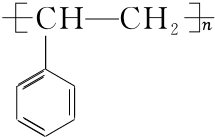 ��
�� ���� A��ˮ���Ĵ������AΪCH2=CH2��C�������г������л���ܷ�����Ӧ����A����Ϸ�Ӧ����֪��CΪCH3CH2OH��A��HCl�����ӳɷ�Ӧ����B��B�ܷ�����ȥ��Ӧ����A����BΪCH3CH2Cl��B������Ӧ����D��D����һϵ�з�Ӧ����I��H�����Ӿ۷�Ӧ����H����D��H��̼ԭ�Ӹ�������8��B����ȡ����Ӧ����D����DΪ ��D����������Ӧ����EΪ
��D����������Ӧ����EΪ ��C��E����������Ӧ����F������F��Է�������֪��F�ṹ��ʽΪ
��C��E����������Ӧ����F������F��Է�������֪��F�ṹ��ʽΪ ��
��
D����ȡ����Ӧ����G��G����ȡ����Ӧ����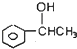 ����GΪ
����GΪ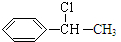 ��G������ȥ��Ӧ����HΪ
��G������ȥ��Ӧ����HΪ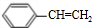 ��H�����Ӿ۷�Ӧ���ɸ߾���IΪ
��H�����Ӿ۷�Ӧ���ɸ߾���IΪ ���ݴ˷������
���ݴ˷������
��� �⣺A��ˮ���Ĵ������AΪCH2=CH2��C�������г������л���ܷ�����Ӧ����A����Ϸ�Ӧ����֪��CΪCH3CH2OH��A��HCl�����ӳɷ�Ӧ����B��B�ܷ�����ȥ��Ӧ����A����BΪCH3CH2Cl��B������Ӧ����D��D����һϵ�з�Ӧ����I��H�����Ӿ۷�Ӧ����H����D��H��̼ԭ�Ӹ�������8��B����ȡ����Ӧ����D����DΪ ��D����������Ӧ����EΪ
��D����������Ӧ����EΪ ��C��E����������Ӧ����F������F��Է�������֪��F�ṹ��ʽΪ
��C��E����������Ӧ����F������F��Է�������֪��F�ṹ��ʽΪ ��
��
D����ȡ����Ӧ����G��G����ȡ����Ӧ���� ����GΪ
����GΪ ��G������ȥ��Ӧ����HΪ
��G������ȥ��Ӧ����HΪ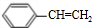 ��H�����Ӿ۷�Ӧ���ɸ߾���IΪ
��H�����Ӿ۷�Ӧ���ɸ߾���IΪ ��
��
��1��ͨ�����Ϸ���֪��A��C��E�ṹ��ʽ�ֱ�ΪCH2�TCH2��CH3CH2OH�� ��
��
�ʴ�Ϊ��CH2�TCH2��CH3CH2OH�� ��
��
��2���ڢ١���6����Ӧ�У�������ȥ��Ӧ���Ǣڢޣ�
�ʴ�Ϊ���ڢޣ�
��3����Ϊ������ͱ���ȡ����Ӧ����Ӧ����ʽΪ�� ��
��
��Ϊ�Ҵ�����ȥ��Ӧ����Ӧ����ʽΪCH3CH2OH$��_{Ũ����}^{170��}$CH2�TCH2��+H2O��
��Ӧ����ʽΪ ��
��
H��I��Ӧ����ʽΪ��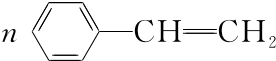 $\stackrel{����}{��}$
$\stackrel{����}{��}$ ��
��
�ʴ�Ϊ�� ��
��
CH3CH2OH$��_{Ũ����}^{170��}$CH2�TCH2��+H2O�� ��
��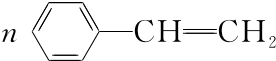 $\stackrel{����}{��}$
$\stackrel{����}{��}$ ��
��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶ���������ȷ�����й����ż������ʹ�ϵ����Ӧ��������Ӧ�ص��ǽⱾ��ؼ���ע���Ϸ�Ӧ�����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
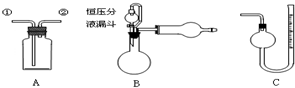
| A�� | װ��A�Ӣٽ���������ˮ�����ռ�NO���� | |
| B�� | װ��A��ʢ����Na2CO3��Һ���Ӣٽ�����ȥCO2�л��е�HCl | |
| C�� | װ��A��B��ϣ���A�Тٽ������Ʊ����ռ����﴿����NH3 | |
| D�� | װ��B��C��ϣ��ɲⶨһ��������Ʒ��Zn�������̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������أ�K2FeO4����һ�����͡���Ч�����ˮ������������ɱ���������ܾ�ˮ | |
| B�� | ���⻯ѧ���������������ն������γɶ��뵪���������й� | |
| C�� | ʹ�ú�12C�IJ�Ʒ������ʹ�ú�13C��14C�IJ�Ʒ���ϡ��ٽ���̼���á���ּ | |
| D�� | �ߴ��ȵĶ�������㷺�����������ά�����ά��ǿ��ᡰ��·�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +283.5 kJ•mol-1 | B�� | -172.5 kJ•mol-1 | C�� | +172.5 kJ•mol-1 | D�� | -504 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.6 g Fe���������ᷴӦ����Ӧ��ת�Ƶĵ�����Ϊ0.3NA | |
| B�� | 0.1 mol FeCl3��ȫˮ��ת��Ϊ�����������壬����0.1NA������ | |
| C�� | �����£�28 g��N2��CO������庬�е�ԭ����Ϊ2NA | |
| D�� | 1mol Na2O2������CO2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������Ʊ������ˮ����μ�������������������Һ���������������Һ���Ϊ���ɫ��ֹͣ���� | |
| B�� | ������ƿ������Һʱ������ʱ���ӿ̶��ߣ�������ҺŨ��ƫ�� | |
| C�� | �к���ʵ�飬�ڲ���ʱӦ����Һ�ֶ�ε������У��Է�Һ�彦����������� | |
| D�� | ��ȡ��ˮ�еĵ�ʵ��ʱ������ˮ�����Һ©����Ȼ����ע���Ҵ��������÷ֲ���²���ɫҺ���ȴ��¿ڷų���֮���ϲ���ɫҺ����Ͽڵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼������Һ�������������������壺2CO32-+SO2+H2O�T2HCO3��+SO32- | |
| B�� | ���������������� Al+2H+�TAl3++H2�� | |
| C�� | ��������ˮ S2-+H2O�TH2S��+2OH- | |
| D�� | ̼��þ���������� CO32��+2H+�TH2O+CO2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com