
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②为___________;
(2)固体A为____________;
(3)写出有关反应的化学方程式__________________。
【答案】Fe过滤Cu和FeFe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑
【解析】
工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,可用单质铁置换出铜,则结合流程可知原料①为Fe,操作①为过滤,所得固体为铁和铜,原料②为稀硫酸溶解金属铁,然后过滤得到铜和硫酸亚铁溶液,将二次的滤液合并得到硫酸亚铁溶液,然后通过操作③蒸发、浓缩、结晶、过滤,可得到FeSO4·7H2O,以此来解答。
根据以上分析可知原料①为Fe,操作①为过滤,原料②为稀硫酸,操作③蒸发、浓缩、结晶、过滤,则
(1)原料①的试剂为Fe,操作②为过滤;
(2)固体A是Cu和Fe;
(3)根据以上分析可知反应的化学方程式为Fe+CuSO4=FeSO4+Cu、Fe+H2SO4=FeSO4+H2↑。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数的关系如图所示。Y与Z能形成Z2Y、Z2Y2型离子化合物R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡。下列说法正确的是

A. 简单氢化物的热稳定性:R>Y
B. 简单离子的半径:Y>Z
C. 最高价氧化物对应水化物的酸性:R>T
D. Y与T属于同一主族、与X属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaH2常作为生氢剂,其中氢元素呈﹣1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
A.还原剂
B.氧化剂
C.既是还原剂又是氧化剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅠA、ⅦA族元素及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态钠原子核外电子排布式为_______;ⅠA族元素的基态原子价层电子云轮廓图为_______。
(2)H2分子中轨道重叠方式是________( 填标号)。
A.s-s B.s-p C.p-p
与H2F+互为等电子体的分子是________( 填一种即可)。
(3)OF2、O2F2是氟化物。OF2 分子的中心原子杂化类型是________;氯的含氧酸通式表示为HClOx,若某种氯的含氧酸中阴离子立体构型为三角锥形,则x=________。
(4)碱金属单质的熔点随原子序数增大而降低,而卤素单质的熔点,沸点随原子序数增大而升高,其原因是________________________________。
(5)钠、钾晶胞如图A所示,其堆积方式是________。



(6)氢化钠晶胞如图B所示(白球代表H+,黑球代表Na+),图C是氢化钠晶胞的截面图。
已知NA代表阿伏加德罗常数的值,晶体密度为dg·cm-3。
①氢化钠晶胞中阴离子的配位数为________。
②Na+半径为________pm(只列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73g氯化氢(HCl)气体,则:
(1)该气体的摩尔质量为_____________。
(2)该气体的物质的量为________mol,所含分子总数为_________个。
(3)该气体在标准状况下的体积为_____________L。
(4)可用于分离或提纯物质的方法有①过滤 ②结晶 ③升华④分液(填序号)。
a.除去石灰水中悬浮的碳酸钙颗粒_________;
b.除去氯化钠中混有的碘单质(碘易由固态变为气态)__________;
c.分离水与苯的混合物____________。
(5)在标准状况下,测得1.92g某气体的体积为672ml计算此气体的相对分子质量__________。
(6)N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为_______;物质的量之比为___________;同温同压下体积比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,体积均为20 mL、浓度均为0.1 mol L-1的两种酸HX、HY分别与0.1 mol L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是

A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如图:
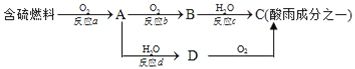
请回答下列问题:
①酸雨的pH_____(填“>”、“<”或“=”)5.6;
②D物质的化学式为_____;
③反应b的化学方程式为_____;
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应生成氮气和水的化学方程式:____________________,反应中氧化剂是____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质进行一氯取代后,生成的产物只有2种的是
A.(CH3)2CHCH(CH3)2
B.(CH3)3CCH2CH3
C.(CH3CH2)2CHCH3
D.(CH3)4C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是—85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是____________、_____________。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的_______溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易与水反应,其产物为两种酸,写出PF5与水反应的化学方程式:________________________________________。
(3)第④步分离采用的方法是_______;第⑤步分离尾气中HF、HCl采用的方法是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com