
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如图:
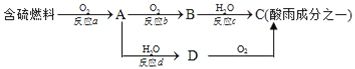
请回答下列问题:
①酸雨的pH_____(填“>”、“<”或“=”)5.6;
②D物质的化学式为_____;
③反应b的化学方程式为_____;
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应生成氮气和水的化学方程式:____________________,反应中氧化剂是____;
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
【题目】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用富含纤维素的木屑在较浓硫酸的作用下,膨胀、水解,生成葡萄糖;酸性条件下,葡萄糖与阳极泥中的二氧化锰反应生成可溶性的硫酸锰。

回答下列问题:
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为__________。
(2)配平“浸出”步骤中发生反应的化学方程式:C6 H12O6+_____MnO2+_____H2SO4=____MnSO4+____CO2↑+____H2O,_____________________
(3)若取消“除酸”操作步骤,将会产生______气体(写化学式)而污染环境。
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式:__________。
(5)取一定量的阳极泥进行实验分析,得到如右图象。硫酸的最合适用量为_____mL,若再增加硫酸的用量,将会导致________。(写化学式)的消耗量增大。

(6)某阳极泥中MnO2的质量分数为50.0%,将174 g该阳极泥与320 g浓盐酸(溶质质量分数为36.5%)混合加热,则产生的氯气在标准状况下应少于_____L(精确到0.1,假设阳极泥中的其他成分不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②为___________;
(2)固体A为____________;
(3)写出有关反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2与CH4在光照条件下,按照体积比1:1反应,则生成的产物为
A.CH3ClB.CH2Cl2C.HClD.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是________________________;
②计算该条件下反应的平衡常数K=________________________。
③已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率________ (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
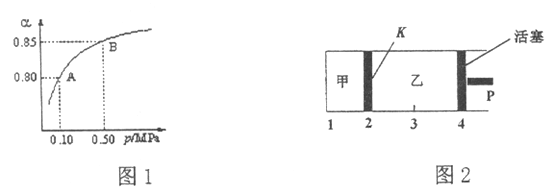
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲_______乙。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com