
【题目】下列离子方程式书写正确的是
A.铜溶于氯化铁浓溶液中:Cu + Fe3+=Cu2+ + Fe2+
B.NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH![]() + OH- =NH3·H2O
+ OH- =NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ =2Ag++ CO2↑+ H2O
D.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
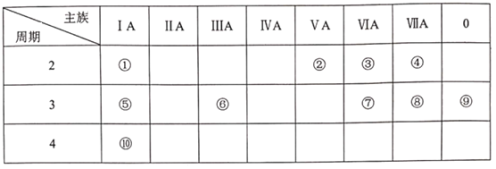
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从小白菊中提取的一种有机物。下列关于该有机物的说法正确的是
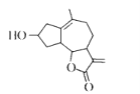
A.可在酸件或碱性溶液中稳定存在
B.其同分异构体存在芳香族化合物
C.能使溴水或酸性KMnO4溶液褪色,其原理相同
D.分子中所有原子一定在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验存在不合理的装置是
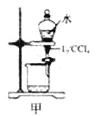
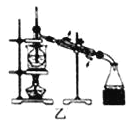
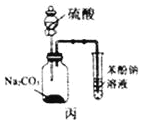

A.装置甲:用CCl4萃取碘水中的碘
B.装置乙:加热碘的CCl4溶液,分离碘并回收CCl4
C.装置丙:验证硫酸、碳酸、苯酚溶液的酸性
D.用乙酸、乙醇制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1 以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
![]()
①可用_______为试剂检验水样中是否含有苯酚。
②操作I的名称为_______,试剂a的化学式为_______。
③通入CO2发生反应生成苯酚的化学方程式为________。
(2)某有机物的分子式为C3H6O3。
①1 mol该有机物充分燃烧消耗的O2在标准状况下的体积为_________L。
②若两分子该有机物能生成六元环状结构,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
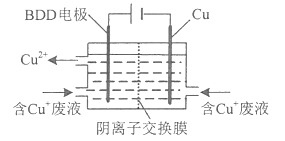
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
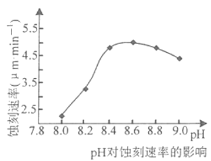
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
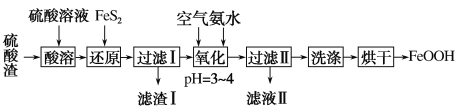
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________。
(2)滤渣I的主要成分是FeS2、S和___________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com