
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
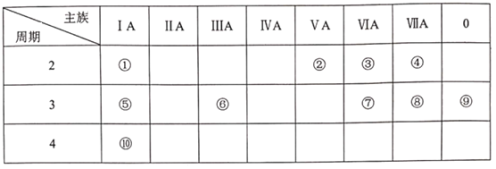
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
【答案】Cl2 + 2OH = Cl + ClO + H2O ![]() Al 2Al + 2OH + 2H2O = 2AlO
Al 2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑ S2 > K+ > F > Na+ HClO4 H2S
+ 3H2↑ S2 > K+ > F > Na+ HClO4 H2S
【解析】
根据元素在周期表中的位置可知,①为Li元素,②为N元素,③为O元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,⑩为K元素,结合元素周期律和物质的性质分析解答。
(1)⑧为Cl元素,氯气是有毒气体, 它能与强碱稀溶液反应生成两种盐,反应的离子方程式为Cl2 + 2OH = Cl + ClO + H2O,③为O元素,⑤为Na元素,二者构成的具有漂白性的化合物为过氧化钠,其电子式为![]() ,故答案为:Cl2 + 2OH = Cl + ClO + H2O;
,故答案为:Cl2 + 2OH = Cl + ClO + H2O;![]() ;
;
(2)上述十种元素中能形成两性氧化物的元素是Al, ⑩为K元素,⑩的最高价氧化物的水化物为KOH,铝与氢氧化钾反应的离子方程式为2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑,故答案为:Al;2Al + 2OH + 2H2O = 2AlO
+ 3H2↑,故答案为:Al;2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑;
+ 3H2↑;
(3)④为F元素,⑤为Na元素,⑦为S元素,⑩为K元素,一般而言,电子层数越多,半径越大,电子层数相同,原子序数越大,半径越小,四种元素简单离子半径由大到小的顺序是S2 >K+ > F >Na+,故答案为:S2 > K+ > F > Na+;
(4)元素的非金属性越强,最高价含氧酸的酸性越强,上述元素中非金属性最强的是F,但F没有最高价含氧酸,因此最高价氧化物对应的水化物酸性最强的是HClO4,非元素的非金属性越弱,气态氢化物还原性越强,上述元素中非金属性最弱的是S,因此非金属气态氢化物还原性最强的是H2S,故答案为:HClO4;H2S。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.钠与水反应:Na + 2H2O = Na++ 2OH-+ H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3-+ 6H+![]() Fe3++ 3NO2↑ + 3H2O
Fe3++ 3NO2↑ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式为C4H8Cl2的有机物共有8种
C.含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D.菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H++ SO2↑+S↓+2Na+ + H2O
B.氢氧化亚铁暴露于空气中会变色:4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
C.将少量的 SO2气体通入NaClO溶液中:SO2 +H2O+ 2ClO- = SO![]() + 2HC1O
+ 2HC1O
D.草酸使酸性KMnO4溶液褪色: 2MnO![]() + 16H++ 5 C2O
+ 16H++ 5 C2O![]() = 2Mn2+ + 10CO2↑+ 8H2O
= 2Mn2+ + 10CO2↑+ 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的有机物,下列说法正确的是
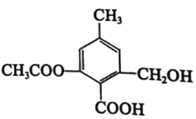
A.分子式为 C10H14O6,属于苯的同系物
B.含有的官能团为羟基、羧基和酯基
C.不能发生取代反应和加成反应,但能发生加聚反应
D.该分子不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量 Al4C3、Al2O3 、C 等杂质。某化学实验小组设计了如下实验, 分别测定氮化铝(AlN)样品中 AlN 和 Al4C3 的质量分数(忽略NH3在强碱溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸发生复分解反应,写出该反应的化学方程式 ___________。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN和NaOH溶液反应的化学方程式_______。实验装置如下图所示:
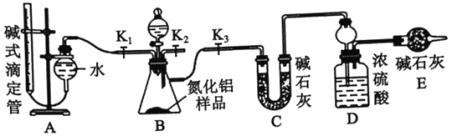
(2)实验过程:
①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为___________。
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入足量的____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量_________(填化学式),与锥形瓶内溶质充分反应。
④_____(填入该步应进行的操作)。
⑤实验中记录滴定管的读数为b mL,称得D装置的质量为z g。
(3)数据
①AlN 的质量分数为____________。
②若读取滴定管中气体的体积时,先冷却到室温,再__________,然后平视凹液面读数。液面左高右低,则所测气体的体积___________(填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 ____________(该实验条件下气体摩尔体积为Vm molL-1) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
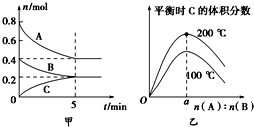
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL-1min-1
B.200℃时,该反应的平衡常数为25L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜溶于氯化铁浓溶液中:Cu + Fe3+=Cu2+ + Fe2+
B.NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH![]() + OH- =NH3·H2O
+ OH- =NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ =2Ag++ CO2↑+ H2O
D.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com