
【题目】关于如图所示的有机物,下列说法正确的是
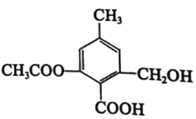
A.分子式为 C10H14O6,属于苯的同系物
B.含有的官能团为羟基、羧基和酯基
C.不能发生取代反应和加成反应,但能发生加聚反应
D.该分子不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色
【答案】B
【解析】
A. 该有机物的分子式为 C11H12O5,其属于烃的衍生物,不属于苯的同系物,A说法不正确;
B. 由该有机物的分子结构可知,其含有的官能团为羟基、羧基和酯基,B说法正确;
C. 该有机物苯环上有2个H,还有2个甲基,故在一定条件下可以发生卤代反应;该有机物还有羟基和羧基,故能发生酯化反应;该有机物还有酯基,可以在一定的条件下发生水解反应;该有机物有苯环,在一定的条件下可以与氢气发生加成反应;但其没有碳碳双键或碳碳叁键,不能发生加聚反应,C说法不正确;
D. 该分子与苯环相连的碳原子中,有两个碳原子上有H原子,而且侧链上还有羟基,故其能使酸性高锰酸钾溶液褪色, D说法不正确。
本题选B。


科目:高中化学 来源: 题型:
【题目】Ⅰ:可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
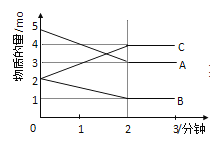
(1)该反应的化学方程式为______________;
(2)恒温恒容下,N2(g)+3H2(g) ![]() 2NH3(g),达到平衡的标志有_______________。
2NH3(g),达到平衡的标志有_______________。
A.3v正(H2)=2v逆(NH3)
B.混合气体总质量不在随时间变化
C.容器内的压强不再随时间而变化
D. N2、H2、NH3的浓度之比为1:2:3
E.单位时间生成nmolN2,同时消耗3nmolH2
F.断开一个N≡N键的同时有6个N—H键生成
Ⅱ:以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
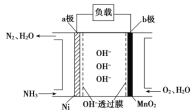
①a极是电池的______________(填“正”或“负”)极,电极反应式为________________。
②当生成0.5molN2时,电路中通过的电子的物质的量为_____。
Ⅲ:甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
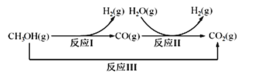
(1)已知一定条件下
反应I: CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是____________________________。
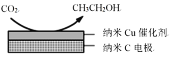
(2)如图,酸性电解质溶液中,电解CO2可以制备乙醇,写出阴极的电极方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) =CH3OCH3(g)+H2O(g) ΔH1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) ![]() CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;1 mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E (kJ · mol-1) | 436 | 343 | 465 | 453 | 413 |
则ΔH1=______kJ·mol-1;ΔH3=______ kJ·mol-1
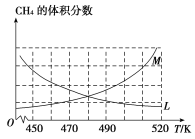
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2 mol CO和6 mol H2,8 min达到平衡,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了有机物G,G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面内,H的分子式是C7H8。
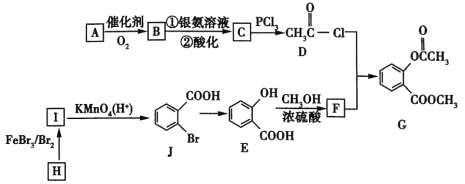
已知:![]() 。
。
回答下列问题。
(1)A的结构简式是___________。
(2)H→I的化学方程式为__________,B与银氨溶液反应的化学方程式是__________。
(3)C→D的反应类型是______,I→J的反应类型是______。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_______________。
(5)满足以下条件的F的同分异构体(不含F)共有_________种。
①能与氯化铁溶液发生显色反应 ②分子中有—COO—结构 ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
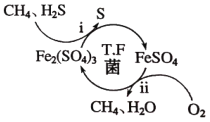
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
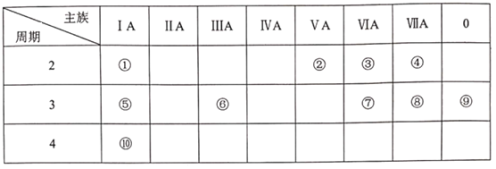
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至60℃,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的说法正确的是
A.甲醇在铜催化和加热条件下生成的产物不存在同分异构体
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热,得到三种烯烃。
C.有机物![]() 的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
D.分子式为C5H10O2的有机物中含有![]() 结构的同分异构体有12种
结构的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1 以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
![]()
①可用_______为试剂检验水样中是否含有苯酚。
②操作I的名称为_______,试剂a的化学式为_______。
③通入CO2发生反应生成苯酚的化学方程式为________。
(2)某有机物的分子式为C3H6O3。
①1 mol该有机物充分燃烧消耗的O2在标准状况下的体积为_________L。
②若两分子该有机物能生成六元环状结构,写出该反应的化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com