
【题目】(1).向纯碱溶液中滴入酚酞溶液,①观察到的现象是__________________,原因是_______(用离子方程式表示)。
②若微热溶液,观察到的现象是__________________,原因是____________________。
(2).在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
① 若加入AgNO3固体,c(I-)__________。
② 若加入更多的AgI固体,则c(Ag+)__________。
【答案】溶液变红色 CO32-+H2O![]() OH-+HCO3- 红色加深 加热,水解程度变大,溶液碱性增强 减小 不变
OH-+HCO3- 红色加深 加热,水解程度变大,溶液碱性增强 减小 不变
【解析】
(1)根据CO32-的水解方程式以及水解为吸热反应,加热,碳酸钠水解平衡向生成碱的方向移动进行分析;
(2)在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,平衡状态下存在溶度积常数,依据平衡影响因素分析平衡的变化。
(1)①纯碱是强碱弱酸盐,在纯碱溶液中,CO32-易水解生成氢氧根离子:CO32-+H2OHCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,滴入酚酞,溶液变红色,
故答案为:溶液变红色;CO32-+H2OOH-+HCO3-。
②碳酸根离子的水解为吸热反应,加热,碳酸钠水解平衡向生成碱的方向移动,溶液碱性增强,导致溶液红色变深,
故答案为:红色变深;加热,水解程度变大,溶液碱性增强。
(2)在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(s)Ag+(aq)+I-(aq),平衡状态下存在溶度积常数,Ksp=c(Ag+)c(I-);
①若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡AgI(s)Ag+(aq)+I-(aq),左移,c(I-)减小,故答案为:减小。
②若加入更多的AgI固体,沉淀溶解平衡AgI(s)Ag+(aq)+I-(aq)不变,则c(Ag+)不变,故答案为:不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以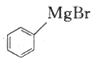 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×102,Ka2 (H2C2O4 ) =5.4×105,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4) +c(C2O42)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A. 0.1000 mol·L1 H2C2O4溶液:c(H+ ) =0.1000 mol·L1+c(C2O42 )+c(OH)c(H2C2O4 )
B. c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42 ) >c(H+ )
C. pH = 7的溶液:c(Na+ ) =0.1000 mol·L1+ c(C2O42) c(H2C2O4)
D. c(Na+ ) =2c(总)的溶液:c(OH) c(H+) = 2c(H2C2O4) +c(HC2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质的溶液在蒸发皿中加热蒸干并灼烧(400℃),可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3
C. MgSO4 D. KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨甲环酸(F)又称止血环酸、凝血酸,是一种在外科手术中广泛使用的止血药,可有效减少术后输血。氨甲环酸(F)的一种合成路线如下(部分反应条件和试剂未标明):

(1)B的系统命名为_______;反应①的反应类型为_____。
(2)化合物C含有的官能团的名称为_____。
(3)下列有关氨甲环酸的说法中,正确的是_____(填标号)。
a.氨甲环酸的分子式为C8H13NO2
b.氨甲环酸是一种天然氨基酸
c.氨甲环酸分子的环上一氯代物有4种
d.由E生成氨甲环酸的反应为还原反应
(4)氨甲环酸在一定条件下反应生成高分子化合物的化学方程式为________。
(5)写出满足以下条件的D的同分异构体的结构简式_____。
①属于芳香族化合物 ②具有硝基 ③核磁共振氢谱有3组峰
(6)写出用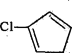 和CH2=CHOOCCH3为原料制备化合物
和CH2=CHOOCCH3为原料制备化合物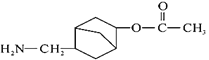 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具,下图为元素周期表的一部分,请按要求填空:

(1)N在元素周期表中的位置是______________ ;N和F处于同一行,是由于它们的 __________ 相同。
(2)以上元素中,原子半径最小的是 ________ (写元素符号);最高价氧化物对应水化物中酸性最强的是 ______________ (写化学式)。
(3)Mg和Al中,金属性较强的是 __________ (写元素符号),写出一条能说明该结论的事实_________________________________。
(4) S和Cl中,非金属性较强的是 __________ (写元素符号),不能说明该结论的事实是_________。
a.氯气与铁反应生成 FeCl3,硫与铁反应生成FeS
b.把 Cl2通入 H2S溶液中能发生置换反应
c.受热时 H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H(3一溴-5-甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线 合成。

请回答下列问题:
(1)C的化学名称为________,G中所含的官能团有醚键、_______、__________(填名称)。
(2)B的结构简式为________,B生成C的反应类型为___________。
(3)由G生成H的化学方程式为_________。E→F是用“H2/Pd”将硝基转化为氨基,而C→D选用的是(NH4)2S,其可能的原因是________。
(4)化合物F的同分异构体中能同时满足下列条件的共有________种。
①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应
(5)设计用对硝基乙苯 为起始原料制备化合物
为起始原料制备化合物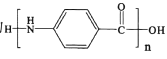 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
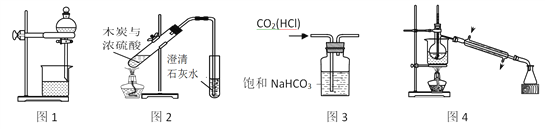
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com