
【题目】将下列物质的溶液在蒸发皿中加热蒸干并灼烧(400℃),可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3
C. MgSO4 D. KMnO4
【答案】C
【解析】
A.AlCl3是强酸弱碱盐,加热发生水解反应产生氢氧化铝和氯化氢,氯化氢有挥发性,所以随着不断加热水分的蒸发,氯化氢气体也不断逸出,蒸干得到的固体是Al(OH)3,灼烧发生反应2Al(OH)3![]() Al2O3 +3H2O,故蒸干并灼烧得到的固体是Al2O3,故A错误;
Al2O3 +3H2O,故蒸干并灼烧得到的固体是Al2O3,故A错误;
B.发生反应2NaHCO3![]() Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3,故B错误;
Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3,故B错误;
C.MgSO4是不挥发性的强酸与弱碱反应生成的盐,水解产生的酸碱会重新生成MgSO4和水。最后得到的固体是MgSO4,故C正确;
D.KMnO4是强酸强碱盐,在溶液中不发生水解反应,但在蒸干后加热会发生分解反应:2KMnO4![]() K2MnO4+MnO2+O2↑,所以最后得到固体是K2MnO4和MnO2的混合物,故D错误。
K2MnO4+MnO2+O2↑,所以最后得到固体是K2MnO4和MnO2的混合物,故D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
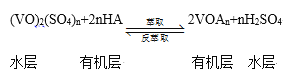
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 0.2 mol FeI2与足量氯气反应时转移电子数为0.4NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
D. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).向纯碱溶液中滴入酚酞溶液,①观察到的现象是__________________,原因是_______(用离子方程式表示)。
②若微热溶液,观察到的现象是__________________,原因是____________________。
(2).在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
① 若加入AgNO3固体,c(I-)__________。
② 若加入更多的AgI固体,则c(Ag+)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O![]() 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
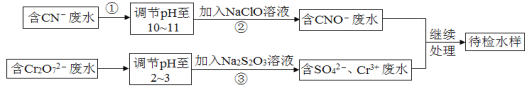
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______。
(2)步骤③的反应为![]() (未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______。
(4)在25℃下,将![]() 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______;________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com