
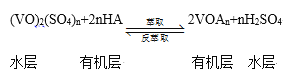
ЁОЬтФПЁПЗАЃЈVЃЉЮЊЙ§ЖЩдЊЫиЃЌПЩаЮГЩЖрМлЬЌЛЏКЯЮяЃЌШЋЗАвКСїЕчГиЪЧвЛжжаТаЭЕФТЬЩЋЛЗБЃДЂФмЯЕЭГЃЌЙЄзїдРэШчЯТЭМЃК

вбжЊЃК
РызгжжРр | VO2+ | VO2+ | V3+ | V2+ |
беЩЋ | ЛЦЩЋ | РЖЩЋ | ТЬЩЋ | зЯЩЋ |
ЃЈ1ЃЉШЋЗАвКСїЕчГиЗХЕчЪБV2+ЗЂЩњбѕЛЏЗДгІЃЌИУЕчГиЗХЕчЪБзмЗДгІЪНЪЧ_______
ЃЈ2ЃЉЕБЭъГЩДЂФмЪБЃЌе§МЋШмвКЕФбеЩЋЪЧ __________
ЃЈ3ЃЉжЪзгНЛЛЛФЄЕФзїгУЪЧ_________
ЃЈ4ЃЉКЌЗАЗЯЫЎЛсдьГЩЫЎЬхЮлШОЃЌЖдКЌЗАЗЯЫЎЃЈГ§VO2+ЭтЃЌЛЙКЌFe3+ЕШЃЉНјаазлКЯДІРэПЩЪЕЯжЗАзЪдДЕФЛиЪеРћгУЃЌСїГЬШчЯТЃК

вбжЊШмвКЫсМюадВЛЭЌЗАдЊЫиЕФДцдкаЮЪНВЛЭЌЃК
ЗАЕФЛЏКЯМл | Ысад | Мюад |
+4Мл | VO2+ | VO(OH)3- |
+5Мл | VO2+ | VO43- |
ЂйТЫвКжаЗАдЊЫиЕФжївЊДцдкаЮЪНЮЊ_______
ЂкТЫдќдкПеЦјжагЩЛвАзЩЋзЊБфЮЊКьКжЩЋЃЌгУЛЏбЇгУгяБэЪОМгШыNaOHКѓЩњГЩГСЕэЕФЗДгІЙ§ГЬ_______________ЁЂ____________ЁЃ
ЂлнЭШЁЁЂЗДнЭШЁПЩЪЕЯжЗАЕФЗжРыКЭИЛМЏЃЌЙ§ГЬПЩМђЕЅБэЪОЮЊЃЈHAЮЊгаЛњнЭШЁМСЃЉЃК
нЭШЁЪББиаыМгШыЪЪСПМюЃЌЦфдвђЪЧ __________
ЂмДПЗАПЩгЩШлбЮЕчНтЗЈОЋСЖЃЌДжЗАЃЈКЌдгжЪЃЉзї____МЋЁЃ
ЁОД№АИЁПV2+ +VO2++2H+=V3++VO2++H2O ЛЦЩЋ зшИєбѕЛЏМСгыЛЙдМСЃЌЪЙЧтРызгЭЈЙ§аЮГЩЕчСї VO(OH)3- Fe2+ + 2OH-=Fe(OH)2Ё§ 4Fe(OH)2+2H2O+O2=4Fe(OH)3 МгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪ бєМЋ
ЁОНтЮіЁП
ЃЈ1ЃЉBМЋЪЧV2+ЪЇЕчзгЗЂЩњбѕЛЏЗДгІЩњГЩV3+ЃЌAМЋVO2+ЕУЕНЕчзгЗЂЩњЛЙдЗДгІЩњГЩVO2+ЃЌИљОнЕчМЋЗДгІЪНЪщаДзмЗДгІЪНЃЛ
ЃЈ2ЃЉДЂФмЮЊГфЕчЙ§ГЬЃЌе§МЋКЭЭтНгЕчдДе§МЋЯрСЌЃЌБОЩэзїбєМЋЗЂЩњбѕЛЏЗДгІЃЌЕчМЋЗДгІЗНГЬЪНЮЊЃКVO2+- e-+H2O= VO2++2H+ЃЛ
ЃЈ3ЃЉжЪзгНЛЛЛФЄЕФзїгУЪЧзшИєбѕЛЏМСгыЛЙдМСЃЌЪЙЧтРызгЭЈЙ§аЮГЩЕчСїЃЛ
ЃЈ4ЃЉЂйгЩСїГЬПЩжЊТЫвКЮЊМюадЧвМгШыЬњЗлКѓVO2+БЛЛЙдЮЊVO(OH)3-ЃЛ
ЂкFe2+ + 2OH-=Fe(OH)2Ё§ЁЂ4Fe(OH)2+2H2O+O2=4Fe(OH)3 ЁЃ
ЂлЗжЮіЦНКтЃЌ![]() ЃЌМгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪЃЛ
ЃЌМгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪЃЛ
ЂмЕчНтЗЈОЋСЖЗАЃЌгУДжЗАзїбєМЋЃЌЗЂЩњбѕЛЏЗДгІЁЃ
ЃЈ1ЃЉвђЮЊЗХЕчЪБЃЌвбжЊBМЋЪЧV2+ЪЇЕчзгЗЂЩњбѕЛЏЗДгІЩњГЩV3+ЃЌЫљвдAМЋЛсЕУЕНЕчзгЗЂЩњЛЙдЗДгІЃЌЙЪЕчМЋЗДгІЗНГЬЪНЮЊЃКVO2++e-+2H+=VO2++H2OЃЌЙЪЕчГиЗХЕчЪБзмЗДгІЪНЪЧV2+ +VO2++2H+=V3++VO2++H2OЃЌ
ЙЪД№АИЪЧЃКV2+ +VO2++2H+=V3++VO2++H2OЃЛ
ЃЈ2ЃЉДЂФмЮЊГфЕчЙ§ГЬЃЌе§МЋКЭЭтНгЕчдДе§МЋЯрСЌЃЌБОЩэзїбєМЋЗЂЩњбѕЛЏЗДгІЃЌЕчМЋЗДгІЗНГЬЪНЮЊЃКVO2+- e-+H2O= VO2++2H+ЃЌЫљвдЕБЭъГЩДЂФмЪБЃЌе§МЋШмвКЕФбеЩЋЪЧЛЦЩЋЃЛ
ЙЪД№АИЪЧЃКЛЦЩЋЃЛ
ЃЈ3ЃЉгЩЕчГиЗХЕчЪБзмЗДгІЪНV2++VO2++2H+=V3++VO2++H2OПЩжЊЃЌСНЕчМЋЕФЮяжЪЛьКЯЛсЗЂЩњЗДгІЃЌЙЪжЪзгНЛЛЛФЄЕФзїгУЪЧзшИєбѕЛЏМСгыЛЙдМСЃЌЪЙЧтРызгЭЈЙ§аЮГЩЕчСїЃЛ
ЙЪД№АИЪЧЃКзшИєбѕЛЏМСгыЛЙдМСЃЌЪЙЧтРызгЭЈЙ§аЮГЩЕчСїЃЛ
ЃЈ4ЃЉЂйИљОнБэжааХЯЂЃЌгЩСїГЬПЩжЊТЫвКЮЊМюадЧвМгШыЬњЗлКѓVO2+БЛЛЙдЮЊVO(OH)3-ЃЌЫљвдЗАдЊЫиЕФжївЊДцдкаЮЪНЮЊVO(OH)3-ЃЌ
ЙЪД№АИЪЧЃКVO(OH)3-ЃЛ
ЂкМгШыЧтбѕЛЏФЦжЎКѓЃЌгЩЛвАзЩЋзЊБфЮЊКьКжЩЋЃЌетЪЧбЧЬњРызгзЊЛЏЮЊЬњРызгЃЌЗДгІЙ§ГЬЮЊFe2+ + 2OH-=Fe(OH)2Ё§ЁЂ4Fe(OH)2+2H2O+O2=4Fe(OH)3ЁЃ
ЙЪД№АИЮЊЃКFe2+ + 2OH-=Fe(OH)2Ё§ЃЛ 4Fe(OH)2+2H2O+O2=4Fe(OH)3ЃЛ
ЂлЗжЮіЦНКтЃЌ![]() ЃЌМгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪЃЌ
ЃЌМгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪЃЌ
ЙЪД№АИЮЊЃКМгШыМюжаКЭСђЫсЃЌДйЪЙЦНКте§ЯђвЦЖЏЃЌЬсИпЗАЕФнЭШЁТЪЃЛ
ЂмЕчНтЗЈОЋСЖЗАЃЌгУДжЗАзїбєМЋЃЌЗЂЩњбѕЛЏЗДгІЃЌ
ЙЪД№АИЮЊЃКбєМЋЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОлЬМЫсѕЅЃЈМђГЦPCЃЉЪЧживЊЕФЙЄГЬЫмСЯЃЌФГжжPCЫмСЯ(N)ЕФКЯГЩТЗЯпШчЯТЃК
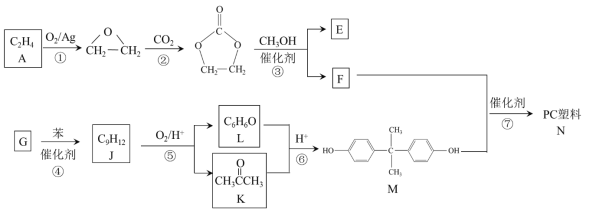
вбжЊЃК
iЃЎR1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
iiЃЎR1CH=CHR2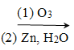 R1CHO + R2CHO
R1CHO + R2CHO
ЃЈ1ЃЉA жаКЌгаЕФЙйФмЭХУћГЦЪЧ______ЁЃ
ЃЈ2ЃЉЂйЁЂЂкЕФЗДгІРраЭЗжБ№ЪЧ______ЁЂ______ЁЃ
ЃЈ3ЃЉЂлЕФЛЏбЇЗНГЬЪНЪЧ______ЁЃ
ЃЈ4ЃЉЂмЪЧМгГЩЗДгІЃЌGЕФКЫДХЙВеёЧтЦзгаШ§жжЗхЃЌGЕФНсЙЙМђЪНЪЧ______ЁЃ
ЃЈ5ЃЉЂожаЛЙгаПЩФмЩњГЩЕФгаЛњЮяЪЧ______ЃЈаДГівЛжжНсЙЙМђЪНМДПЩЃЉЁЃ
ЃЈ6ЃЉЂпЕФЛЏбЇЗНГЬЪНЪЧ______ЁЃ
ЃЈ7ЃЉМКЖўШЉЪЧКЯГЩЦфЫћгаЛњЮяЕФдСЯЁЃLОЙ§СНВНзЊЛЏЃЌПЩвджЦБИМКЖўШЉЁЃКЯГЩТЗЯпШчЯТЃК

жаМфВњЮя1ЕФНсЙЙМђЪНЪЧ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNF3ЪЧЮЂЕчзгЙЄвЕжаГЃгУЕФвЛжжЕШРызгЪДПЬЦјЬхЃЌОпгаНЯЧПЕФбѕЛЏадЃЌЙЄвЕЩњВњNF3ГЃгУЕФЗНЗЈгаЦјвЛвКЗДгІЗЈЁЂЦјвЛЙЬЗДгІЗЈКЭЕчНтЗЈЕШЁЃ
ЃЈ1ЃЉЦјвЛвКЗДгІЗЈжаЗЂЩњЕФжїЗДгІКЭИБЗДгІАќРЈЃК
3F2(g)+NH3(l)=NF3(g)+3HF(l) ЁїH1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) ЁїH2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) ЁїH3
NH3(l)+2HF(l)=NH4HF2(l) ЁїH4
ЁїH1=_____ЁЃВПЗжМќФмЪ§ОнШчЯТБэЫљЪОЃЌЁїH3=_____kJ/molЁЃ
ЛЏбЇМќ | N-N | N=N | N | H-F | F-F | N-H | N-F |
МќФмЃЈkJ/molЃЉ | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
ЃЈ2ЃЉЦјвЛЙЬЗДгІЗЈжївЊАќРЈСНВНЗДгІЃК
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) ЗДгІЂё
2NF3(g)+8HF(g)+NH4AlF4(s) ЗДгІЂё
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) ЗДгІЂђ
NF3(g)+4HF(g)+ AlF3(s) ЗДгІЂђ
ЗДгІIЕФЦНКтГЃЪ§K1КЭЗДгІIIЕФЦНКтГЃЪ§ЕФЙиЯЕЪЧ___ЁЃШєдкКуЮТЁЂКуШнЕФУмБеШнЦїжаФЃФтЦјвЛЙЬЗДгІЗЈЃЈЙЬЬхзуСП)ЃЌЦ№ЪМЪБF2ЕФХЈЖШЮЊ5mol/LЃЌЗДгІЙ§ГЬжаШнЦїжабЙЧПвЛЫцЪБМфБфЛЏЧњЯпШчЭМЫљЪОЃЌдђЧА2minЕФЦНОљЗДгІЫйТЪv(NF3)=___mol/(Lmin)ЃЌИУЮТЖШЯТK2=___ЁЃ
ЃЈ3ЃЉЕчНтЗЈЪЧЭЈЙ§ЕчНтКЌЗњЕФШлШкбЮЩњВњNF3ЃЌЦфдРэШчЭМЫљЪОЁЃaашвЊНгЕчдДЕФ____(ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ЃЌЩњГЩЦјЬхAЕФЕчМЋЗДгІЪЧ____ЁЃ
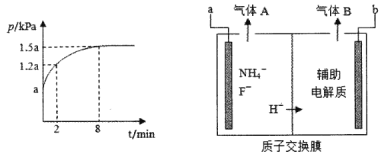
ЃЈ4ЃЉгУNF3ЖдЖрОЇЙшЕчзгдЊМўНјааЪДПЬЪБВЛЛсдкЕчзгдЊМўБэУцаЮГЩШЮКЮВаСєЮяЃЌЦфдвђЪЧ_____ЁЃЃЈгУЛЏбЇгУгяНтЪЭЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПH2C2O4ЮЊЖўдЊШѕЫсЃЌKa1 (H2C2O4 ) =5.4ЁС102ЃЌKa2 (H2C2O4 ) =5.4ЁС105ЃЌЩшH2C2O4ШмвКжаc(зм)=c(H2C2O4) +c(HC2O4) +c(C2O42)ЁЃЪвЮТЯТгУNaOHШмвКЕЮЖЈ25.00 mL 0.1000 molЁЄL1H2C2O4ШмвКжСжеЕуЁЃЕЮЖЈЙ§ГЬЕУЕНЕФЯТСаШмвКжаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕвЛЖЈе§ШЗЕФЪЧ
A. 0.1000 molЁЄL1 H2C2O4ШмвКЃКc(H+ ) =0.1000 molЁЄL1+c(C2O42 )+c(OH)c(H2C2O4 )
B. c(Na+ ) =c(зм)ЕФШмвКЃКc(Na+ ) >c(H2C2O4 ) >c(C2O42 ) >c(H+ )
C. pH = 7ЕФШмвКЃКc(Na+ ) =0.1000 molЁЄL1+ c(C2O42) c(H2C2O4)
D. c(Na+ ) =2c(зм)ЕФШмвКЃКc(OH) c(H+) = 2c(H2C2O4) +c(HC2O4)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтжЪЫЎШмвКжаДцдкЕчРыЦНКтЁЂЫЎНтЦНКтЁЂШмНтЦНКтЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
ЃЈ1ЃЉвбжЊВПЗжШѕЫсЕФЕчРыЦНКтГЃЪ§ШчЯТБэЃК
ШѕЫс | HCOOH | HCN | H2CO3 |
ЕчРыЦНКтГЃЪ§ЃЈ25ЁцЃЉ | Ka=1.77ЁС10Ѓ4 | Ka=5.0ЁС10Ѓ10 | Ka1=4.3ЁС10Ѓ7 Ka2=5.6ЁС10Ѓ11 |
ЂйHCOONaЁЂNaCNЁЂNaHCO3ЁЂNa2CO3ет4жжШмвКжавѕРызгНсКЯжЪзгФмСІзюЧПЕФЪЧ__________________ЁЃ
ЂкЬхЛ§ЯрЭЌЁЂc(H+)ЯрЭЌЕФШ§жжЫсШмвКЂйHCOOHЃЛЂкHCNЃЛЂлH2SO4ЗжБ№гыЭЌХЈЖШЕФNaOHШмвКЭъШЋжаКЭЃЌЯћКФNaOHШмвКЕФЬхЛ§гЩДѓЕНаЁЕФХХСаЫГађЪЧ(ЬюађКХ) _____________ЃЛ
ЃЈ2ЃЉвЛЖЈХЈЖШЕФNaCNШмвКpH=9ЃЌгУРызгЗНГЬЪНБэЪОГЪМюадЕФдвђЪЧ___________ЃЛДЫЪБc(HCN)/c(CN-)=______________ЁЃ
ЃЈ3ЃЉвбжЊCaCO3ЕФKsp=2.8ЁСl0-9ЃЌЯжНЋХЈЖШЮЊ5.6ЁСl0-4mol/LNa2CO3ШмвКгыCaCl2ШмвКЕШЬхЛ§ЛьКЯЃЌдђЩњГЩCaCO3ГСЕэЫљашCaCl2ШмвКЕФзюаЁХЈЖШЮЊ__________ mol/LЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСзЫсбЧЬњяЎЃЈLiFePO4ЃЉЕчГиЪЧаТФмдДЦћГЕЕФЖЏСІЕчГижЎвЛЁЃЗЯОЩЕчГие§МЋЦЌЃЈСзЫсбЧЬњяЎЁЂЬПКкКЭТСВЕШЃЉПЩдйЩњРћгУЃЌЦфЙЄвеСїГЬШчЯТЃК

вбжЊЃКЬМЫсяЎдкЫЎжаЕФШмНтЖШЃЌ0ЁцЪБЮЊ1.54gЃЌ90ЁцЪБЮЊ0.85gЃЌ100ЁцЪБЮЊ0.71gЁЃ
ЃЈ1ЃЉЩЯЪіСїГЬжажСЩйашвЊОЙ§______ДЮЙ§ТЫВйзїЁЃ
ЃЈ2ЃЉЁАбѕЛЏЁБЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ__________ЃЛШєгУHNO3ДњЬцH2O2ВЛзужЎДІЪЧ_____ЁЃ
ЃЈ3ЃЉЂйвбжЊKsp[Fe(OH)3]=2.6ЁС10-39ЁЃГЃЮТЯТЃЌдкFe(OH)3аќзЧвКжаЃЌЕБШмвКЕФpH=3.0ЪБЃЌFe3+ЕФХЈЖШЮЊ________mol/LЁЃ
ЂкЪЕМЪЩњВњЙ§ГЬжаЃЌЁАЕїНкpHЁБЩњГЩГСЕэЪБЃЌШмвКpHгыН№ЪєдЊЫиЕФГСЕэАйЗжТЪ(Іи)ЕФЙиЯЕШчЯТБэЃК
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
Іи(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Іи(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
дђзюМбЕФГСЕэpH=________ЁЃ
ЃЈ4ЃЉЁАГСяЎ" ЪБЕФЮТЖШгІбЁЃЈЬюБъКХЃЉ______ЮЊвЫЃЌВЂгУ___ЯДЕгЃЈЬюЁАШШЫЎ" ЛђЁАРфЫЎ"ЃЉЁЃ
aЃЎ90Ёц bЃЎ60 Ёц cЃЎ30 Ёц dЃЎ0 Ёц
ЃЈ5ЃЉСзЫсбЧЬњяЎЕчГидкЙЄзїЪБЃЌе§МЋЗЂЩњLiFePO4КЭFePO4ЕФзЊЛЏЃЌИУЕчГиЗХЕчЪБе§МЋЕФЕчМЋЗДгІЪНЮЊ________ЁЃ
ЃЈ6ЃЉЙЄвЕЩЯПЩвдгУFePO4ЁЂLi2CO3КЭH2C2O4зїдСЯИпЮТБКЩежЦБИ LiFePO4ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋЯТСаЮяжЪЕФШмвКдкеєЗЂУѓжаМгШШеєИЩВЂзЦЩе(400Ёц)ЃЌПЩвдЕУЕНИУЮяжЪЕФЙЬЬхЕФЪЧ(ЁЁЁЁ)
A. AlCl3 B. NaHCO3
C. MgSO4 D. KMnO4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЊЫижмЦкБэЪЧжИЕМЛЏбЇбЇЯАЕФживЊЙЄОпЃЌЯТЭМЮЊдЊЫижмЦкБэЕФвЛВПЗжЃЌЧыАДвЊЧѓЬюПеЃК

(1)NдкдЊЫижмЦкБэжаЕФЮЛжУЪЧ______________ ЃЛNКЭFДІгкЭЌвЛааЃЌЪЧгЩгкЫќУЧЕФ __________ ЯрЭЌЁЃ
(2)вдЩЯдЊЫижаЃЌдзгАыОЖзюаЁЕФЪЧ ________ (аДдЊЫиЗћКХ)ЃЛзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяжаЫсадзюЧПЕФЪЧ ______________ (аДЛЏбЇЪН)ЁЃ
(3)MgКЭAlжаЃЌН№ЪєадНЯЧПЕФЪЧ __________ (аДдЊЫиЗћКХ)ЃЌаДГівЛЬѕФмЫЕУїИУНсТлЕФЪТЪЕ_________________________________ЁЃ
(4) SКЭClжаЃЌЗЧН№ЪєадНЯЧПЕФЪЧ __________ (аДдЊЫиЗћКХ)ЃЌВЛФмЫЕУїИУНсТлЕФЪТЪЕЪЧ_________ЁЃ
a.ТШЦјгыЬњЗДгІЩњГЩ FeCl3ЃЌСђгыЬњЗДгІЩњГЩFeS
b.Аб Cl2ЭЈШы H2SШмвКжаФмЗЂЩњжУЛЛЗДгІ
c.ЪмШШЪБ H2SвзЗжНтЃЌHClВЛвзЗжНт
d.ЕЅжЪСђЪЧЙЬЬхЃЌТШЕФЕЅжЪЪЧЦјЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПF2КЭXeдквЛЖЈЬѕМўЯТПЩЩњГЩXeF2ЁЂXeF4КЭXeF6Ш§жжЗњЛЏыЏЃЌЫќУЧЖМЪЧМЋЧПЕФбѕЛЏМСЃЈЦфбѕЛЏадвРДЮЕндіЃЉЃЌЖММЋвзЫЎНтЃЌЦфжаЃК6XeF4+12H2O==2XeO3+4XeЁќ +24HF+3O2ЁќЁЃЯТСаЭЦВте§ШЗЕФЪЧЃЈ ЃЉ

A. XeF2ЗжзгжаИїдзгОљДяЕНАЫЕчзгНсЙЙ
B. ФГжжЗњЛЏыЏЕФОЇЬхНсЙЙЕЅдЊШчЭМЃЌПЩЭЦжЊЦфЛЏбЇЪНЮЊXeF6
C. XeF4АДвбжЊЗНЪНЫЎНтЃЌУПЩњГЩ4molXeЃЌзЊвЦ16molЕчзг
D. XeF2МгШыЫЎжаЃЌдкЫЎЗжзгзїгУЯТНЋжиаТЩњГЩXeКЭF2
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com