
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
【答案】5 H2O2+2Fe2++2H+=2Fe3++2H2O 产生氮的氧化物,污染空气 2.6×10-6 8 a 热水 FePO4+e-+Li+=LiFePO4 2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
【解析】
由已知废旧电池正极片为磷酸亚铁锂、炭黑和铝箔等,加氢氧化钠溶液后,铝箔溶解,通过过滤除去含铝的溶液,滤渣加入硫酸,溶解磷酸亚铁锂,炭黑不溶,再过滤除去炭黑,滤液中加入H2O2,氧化Fe2+生成Fe3+,加入NaOH和NH3·H2O调节pH,使Fe3+变成Fe(OH)3沉淀。过滤后除去沉淀,滤液中加入碳酸钠,碳酸锂在水中的溶解度很小,把易容的硫酸锂转化为微溶的碳酸锂即可。
(1)根据上述分析可知上述流程中至少需要经过5次过滤操作。答案:5。
(2)H2O2具有强氧化性,可以把Fe2+氧化生成Fe3+,此反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;若用HNO3代替H2O2容易产生具有污染性的氮的氧化物气体。答案:H2O2+ 2Fe2++2H+=2Fe3++2H2O;产生氮的氧化物,污染空气;
(3)①pH=3.0时,c(H+)=1.0×10-3 mol/L,c(OH-)=1.0×10-11mol/L,Ksp[Fe(OH)3]=2.6×10-39,所以c(Fe3+)=2.6×10-39/(1.0×10-11)3 mol/L =2.6×10-6 mol/L;答案:2.6×10-6。
②由图表数据分析可知pH=8时,铁元素的沉淀率较高,锂元素损失量较小,故应调节pH=8沉淀最佳;答案:8;
(4)因为碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。90℃ 反应速率较快,而碳酸锂溶解度很小,所以“沉锂"时的温度应选90℃为宜,并用热水洗涤。答案:a、热水。
(5)磷酸亚铁锂电池在工作时,正极发生还原反应,所以是FePO4得电子生成,该电池放电时正极的电极反应式为FePO4+e-+Li+=LiFePO4;答案:FePO4+e-+Li+=LiFePO4。
(6)用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备LiFePO4,根据元素守恒即可得到化学方程式为:2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑;答案:2FePO4+ Li2CO3+ H2C2O4
2LiFePO4+H2O+3CO2↑;答案:2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑。
2LiFePO4+H2O+3CO2↑。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、NO2两种气体。将一定量废气通入到足量的Na2CO3溶液中被完全吸收,溶液中生成的NO3-、NO2-两种离子的物质的量与废气中NO2的物质的量分数x![]() 变化关系可用图所示。已知溶液中可发生以下两个反应:
变化关系可用图所示。已知溶液中可发生以下两个反应:
①NO+NO2+Na2CO3=2NaNO2+CO2;
②2NO2+Na2CO3=NaNO2+NaNO3+CO2

下列说法正确的是
A.图中线段a表示NO3-离子
B.随x值增大,溶液中n(NO3-)+n(NO2-)增大
C.x=0.6时,反应中可收集到标准状况下CO2 44.8 L
D.若测得所得溶液中n(NO3-)为0.5 mol,则x值为0.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
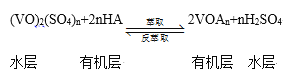
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).向纯碱溶液中滴入酚酞溶液,①观察到的现象是__________________,原因是_______(用离子方程式表示)。
②若微热溶液,观察到的现象是__________________,原因是____________________。
(2).在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
① 若加入AgNO3固体,c(I-)__________。
② 若加入更多的AgI固体,则c(Ag+)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 14g乙烯和丙烯的混合物中极性键数目为2NA
B. 标准状况下,![]() 与
与![]() 在光照条件下反应生成HCl分子数为
在光照条件下反应生成HCl分子数为![]()
C. 容器中2molNO与1molO2充分反应,产物的分子数为2NA
D. 电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com