
【题目】下列是制备Fe(OH)2的实验装置,其中制得的Fe(OH)2容易被氧化的是
A.
B.
C.
D.
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H(3一溴-5-甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线 合成。

请回答下列问题:
(1)C的化学名称为________,G中所含的官能团有醚键、_______、__________(填名称)。
(2)B的结构简式为________,B生成C的反应类型为___________。
(3)由G生成H的化学方程式为_________。E→F是用“H2/Pd”将硝基转化为氨基,而C→D选用的是(NH4)2S,其可能的原因是________。
(4)化合物F的同分异构体中能同时满足下列条件的共有________种。
①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应
(5)设计用对硝基乙苯 为起始原料制备化合物
为起始原料制备化合物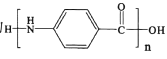 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z可用于防治骨质疏松,可通过X、Y经两步转化得到Z。下列说法正确的是( )
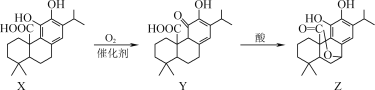
A. X、Y、Z都属于芳香族化合物
B. Y分子中含有3个手性碳原子
C. X、Y、Z与浓溴水反应最多消耗1molBr2
D. 1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )

A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下:
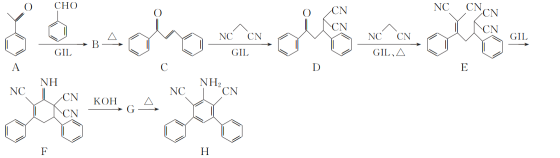
(1)C中含有的官能团名称为_____。
(2)C→D的反应类型为_____。
(3)已知:G和H的分子式相同,F→G和B→C反应类型也相同,那么G的结构简式为_____。
(4)写出满足下列条件的B的一种同分异构体X的结构简式:_____。
①1molX完全水解消耗2molNaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3∶2∶2∶1。
(5)以乙醇为原料利用GIL合成聚酯![]() 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
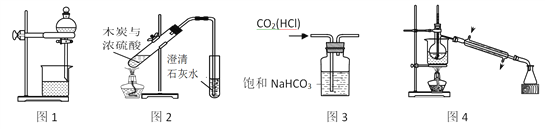
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)C分子中都包含________个σ键,________个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因: ____________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com