
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)C分子中都包含________个σ键,________个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因: ____________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
【答案】Ar 极性 5 0 D是CH3OH,分子之间能形成氢键 CO中断裂1molπ键需吸收能量273kJ,N2中断裂1mol π键需吸收能量523.3kJ,所以CO分子中的π键比N2分子中的π键更容易发生反应 1s22s22p63s23p63d84s2 3d104s1 分子晶体
【解析】
Ⅰ、A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,故A为Ar,B分子中两种原子的个数比均为1:2,故B为H2S,C分子所含原子数目为6,且分子中两种原子的个数比为1:2,故C为N2H4,D是一种有毒的有机物,含有18g电子,甲烷电子数目为10,含有5个原子,再有1个O原子为18电子,故D为CH3OH,甲醇有毒,符合题意,据此解答;
Ⅱ、根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定;
Ⅲ、(6)根据核外电子排布规律书写,注意全满、半满稳定结构;
(7)结合晶体类型与性质进行判断,分子晶体的熔沸点较低。
Ⅰ、A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,故A为氩气,B分子中两种原子的个数比均为1:2,故B为H2S,C分子所含原子数目为6,且分子中两种原子的个数比为1:2,故C为N2H4,D是一种有毒的有机物,含有18g电子,甲烷电子数目为10,含有5个原子,再有1个O原子为18电子,故D为CH3OH,甲醇有毒,符合题意,
(1)A是氩气,组成分子的原子的元素符号是Ar,故答案为:Ar;
(2)B为H2S,S原子成2个S-H单键,含有2对孤对电子,故S为sp3杂化,为V型结构,正负电荷的重心不重合,为极性分子,故答案为:极性;
(3)C为N2H4,分子中含有4个N-H键,1个N-N键,单键是σ键,故分子中有5个σ键,故答案为:5;0;
(4)D是CH3OH,分子之间能形成氢键,熔、沸点比CH4的熔、沸点高,故答案为:D是CH3OH,分子之间能形成氢键;
Ⅱ、(5)由表中数据可知,CO中断裂1molπ键需吸收能量273kJ,N2中断裂1mol π键需吸收能量523.3kJ,所以CO分子中的π键比N2分子中的π键更容易发生反应,故答案为:CO中断裂1molπ键需吸收能量273kJ,N2中断裂1mol π键需吸收能量523.3kJ,所以CO分子中的π键比N2分子中的π键更容易发生反应;
Ⅲ、(6)Ni是28号元素,基态原子的核外电子排布式为1s22s22p63s23p63d84s2,Cu是29号元素,基态原子的核外电子排布式为1s22s22p63s23p63d104s1,价电子排布式为3d104s1;
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点很低,所以分子晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 14g乙烯和丙烯的混合物中极性键数目为2NA
B. 标准状况下,![]() 与
与![]() 在光照条件下反应生成HCl分子数为
在光照条件下反应生成HCl分子数为![]()
C. 容器中2molNO与1molO2充分反应,产物的分子数为2NA
D. 电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | 明矾 | 液态 | 蔗糖 |
B | CaO | 海水 | 铜 | 乙醇 |
C | 胆矾 | 镁合金 | AgCl |
|
D | 氢氧化钠 | 空气 |
| 食醋 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是 ( )
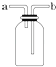
A.洗气或干燥装置:瓶内放一定体积溶液,由a管口进气
B.用于收集难溶于水的气体:瓶内充满水,由b管口进气
C.提供少量CO:瓶内充满CO,b管口接自来水龙头
D.H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
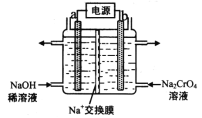
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物和同分异构体的判断正确的是( )
A. C5H12有4种同分异构体
B. ![]() 还有4种含有苯环的同分异构体
还有4种含有苯环的同分异构体
C. C9H20与C2H6一定互为同系物关系
D. C4H8与C2H4一定互为同系物关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到4.3 g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到2.33 g,并有气体产生。求:
(1)原混合物溶液中Na2SO4的物质的量浓度是多少?___________
(2)产生多少mol CO2?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com