
【题目】下列表格中各项分类都正确的一组是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | 明矾 | 液态 | 蔗糖 |
B | CaO | 海水 | 铜 | 乙醇 |
C | 胆矾 | 镁合金 | AgCl |
|
D | 氢氧化钠 | 空气 |
| 食醋 |
A.AB.BC.CD.D
【答案】C
【解析】
同种物质组成的为纯净物,不同物质组成的为混合物,在水溶液中或熔融状态下导电的化合物为电解质,在水溶液中和熔融状态下都不导电的化合物为非电解质。
A.冰水混合物是水,属于纯净物,明矾是硫酸铝钾晶体为纯净物,液态KNO3完全电离属于电解质,蔗糖为非电解质,故A错误;
B.CaO是一种物质组成为纯净物,海水为多种物质组成为混合物,铜为单质不是电解质,乙醇为非电解质,故B错误;
C.胆矾是硫酸铜晶体属于纯净物,铝合金为混合物,氯化银在熔融状态导电属于电解质,二氧化碳不能电离为非电解质,故C正确;
D.氢氧化钠是一种物质组成为纯净物,空气为混合物,硫酸钠溶液是电解质溶液,食醋是醋酸水溶液,故D错误;
故答案选C。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氨甲环酸(F)又称止血环酸、凝血酸,是一种在外科手术中广泛使用的止血药,可有效减少术后输血。氨甲环酸(F)的一种合成路线如下(部分反应条件和试剂未标明):

(1)B的系统命名为_______;反应①的反应类型为_____。
(2)化合物C含有的官能团的名称为_____。
(3)下列有关氨甲环酸的说法中,正确的是_____(填标号)。
a.氨甲环酸的分子式为C8H13NO2
b.氨甲环酸是一种天然氨基酸
c.氨甲环酸分子的环上一氯代物有4种
d.由E生成氨甲环酸的反应为还原反应
(4)氨甲环酸在一定条件下反应生成高分子化合物的化学方程式为________。
(5)写出满足以下条件的D的同分异构体的结构简式_____。
①属于芳香族化合物 ②具有硝基 ③核磁共振氢谱有3组峰
(6)写出用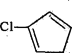 和CH2=CHOOCCH3为原料制备化合物
和CH2=CHOOCCH3为原料制备化合物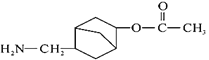 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z可用于防治骨质疏松,可通过X、Y经两步转化得到Z。下列说法正确的是( )
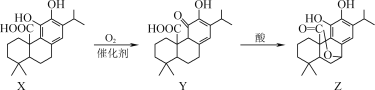
A. X、Y、Z都属于芳香族化合物
B. Y分子中含有3个手性碳原子
C. X、Y、Z与浓溴水反应最多消耗1molBr2
D. 1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下:
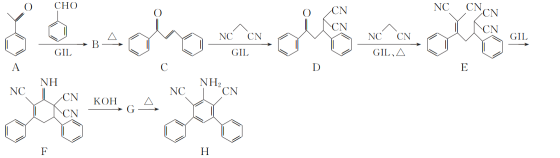
(1)C中含有的官能团名称为_____。
(2)C→D的反应类型为_____。
(3)已知:G和H的分子式相同,F→G和B→C反应类型也相同,那么G的结构简式为_____。
(4)写出满足下列条件的B的一种同分异构体X的结构简式:_____。
①1molX完全水解消耗2molNaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3∶2∶2∶1。
(5)以乙醇为原料利用GIL合成聚酯![]() 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
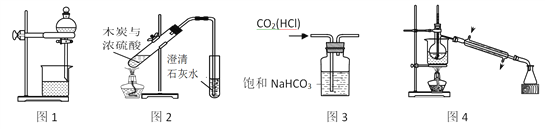
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。

(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_____________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 18 |
化学式 | _______ | ________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)C分子中都包含________个σ键,________个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因: ____________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向20 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1 NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是

A. H2A属于强酸
B. c(HA-)/c(H2A)随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.05 mol·L-1
D. V[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com