
【题目】25 ℃时,向20 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1 NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是

A. H2A属于强酸
B. c(HA-)/c(H2A)随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.05 mol·L-1
D. V[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
【答案】CD
【解析】
A.当没有加入氢氧化钠溶液时,0.1mol/LH2A溶液的pH>3,说明H2A为弱酸;
B.根据H2A的第一步电离平衡常数可知:c(HA)/c(H2A)=Ka1(H2A)/c(H+),所以该比值随着溶液中的氢离子浓度的减小而增大;
C.V[NaOH(aq)]=20mL时,二者恰好反应生成NaHA,根据该溶液中的物料守恒判断;
D.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,HA-的电离程度大于其水解程度,溶液显酸性。
A.结合图象可知,氢氧化钠溶液体积为0时,0.1mol/LH2A溶液的pH>3,说明H2A在溶液中部分电离,属于弱酸,故A错误;
B.根据H2A的第一步电离平衡常数可知:c(HA)/c(H2A)=Ka1(H2A)/c(H+),氢离子浓度与该比值成反比,随着氢氧化钠溶液体积增大,溶液中氢离子浓度逐渐减小,则该比值逐渐增大,故B错误;
C.V[NaOH(aq)]=20mL时,发生反应:NaOH+H2A═NaHA+H2O,溶液中溶质为NaHA,根据物料守恒可得:c(HA-)+c(A2-)+c(H2A)=c(Na+)=0.05mol/L,故C正确;
D.根据图象知,当V(NaOH)=20mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-发生电离和水解,根据图中粒子的物质的量关系可知HA-电离程度大于水解程度,溶液显酸性,水和HA都电离出氢离子,只有HA-电离出A2-,所以离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D正确。
故选CD。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | 明矾 | 液态 | 蔗糖 |
B | CaO | 海水 | 铜 | 乙醇 |
C | 胆矾 | 镁合金 | AgCl |
|
D | 氢氧化钠 | 空气 |
| 食醋 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到4.3 g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到2.33 g,并有气体产生。求:
(1)原混合物溶液中Na2SO4的物质的量浓度是多少?___________
(2)产生多少mol CO2?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Na2CO3水解:CO32-+H2O == H2CO3+2OH-
B. NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O
D. 醋酸除水垢:CO32-+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
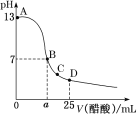
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从电极___(“填A或B”)流向用电器。内电路中,CO32-向电极_____(“填A或B”)移动,电极A上CO参与的电极反应为______________________。

(2)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的电极是原电池的____极,该极的电极反应式是___________。如果消耗甲烷160g,假设化学能完全转化为电能,需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
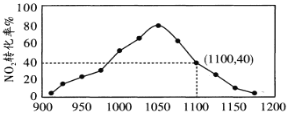
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ)。根据如图图示判断,下列说法正确的是
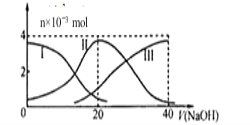
A. 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2ˉ)>c(H+)>c(HAˉ)>c(OHˉ)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HAˉ)= c(A2ˉ)+2c(OHˉ)
D. 向NaHA溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com