

| ||
| △ |
| ||
| △ |
| 1.12L |
| 22.4L/mol |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 140 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性X<Y |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的氢氧化物能溶于稀氨水 |
| D、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
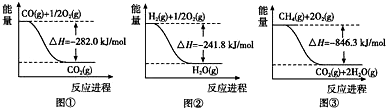
查看答案和解析>>
科目:高中化学 来源: 题型:

| 水 |
| △ |
 的一种香料.
的一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C、氧化剂得电子总数与还原剂失电子总数之比为1:1 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属化学变化 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、HD与D2互为同位素;金刚石、石墨和C60互为同素异形体 |
| D、苯酚有一定毒性,不能作消毒剂和防腐剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com