
| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
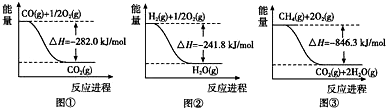
| ||
| 1 |
| 2 |
| 1 |
| 2 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
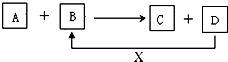 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| B、c(Cl-)+c(OH-)=c(NH4+)+c(H+) |
| C、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com