


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
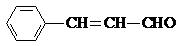 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A、1 mol该有机物发生银镜反应能生成 1 mol Ag |
| B、1 mol该有机物最多能够与6 mol H2 发生加成反应 |
C、它与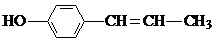 互为同分异构体 互为同分异构体 |
| D、该有机物能被酸性高锰酸钾溶液氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、NO3- |
| C、K+、Fe2+、Cl-、MnO4- |
| D、Ca2+、Na+、Fe3+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
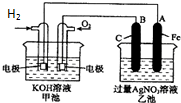 如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯和水,酒精和水,植物油和水 |
| B、四氯化碳和水,溴苯和水,硝基苯和水 |
| C、甘油和水,乙酸和水,乙酸和乙醇 |
| D、酒精和水,苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

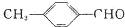 中的含氧官能团,请写出该反应的化学方程式:
中的含氧官能团,请写出该反应的化学方程式: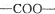 结构的基团
结构的基团查看答案和解析>>
科目:高中化学 来源: 题型:
| 主食 | 米饭 |
| 副食 | 烧豆腐、红烧鱼 |
| 饮料 | 牛奶 |
| 你的补充 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com