
【题目】根据物质的量的有关公式计算(注:(2)(3)(4)计算结果保留小数点后两位)
(1)3.01×1023个NH4+,其质量为 g。
(2)欲配制1L 0.2 mol.L-1的盐酸溶液,需标准状况下HCl的体积为 L。
(3)现将50 mL密度为1.84 g/cm3,质量分数为98.0 %的浓硫酸,稀释至250 mL,则稀释后,溶液的物质的量浓度为 。
(4)19克MgCl2中含有离子数目 。
(5)所含原子数相等的甲烷和氨气(NH3)的质量比为 。
【答案】
(1)9(2)4.48(3)3.68 mol.L-1
(4)3.61×1023(5)64:85
【解析】
试题分析:
(1)n(NH4+)=![]() =0.5mol,m(NH4+)=0.5mol×18g/mol=9g。
=0.5mol,m(NH4+)=0.5mol×18g/mol=9g。
(2)0.2 mol.L-1的盐酸溶液1L ,那么盐酸的物质的量为 0.2×1=0.2。那么需要标准状况下HCl的体积为0.2×22.4=4.48L。
(3)物质的量浓度就是溶质的物质的量除以溶液的总体积,稀释后的溶液总体积为250 mL,而且稀释时,溶质的物质的量不变,所以硫酸物质的量就是50mL×1.84g/mL×98%÷98g/mol=0.92mol,则物质的量浓度就是0.92mol÷0.25L=3.68 mol/L。
(4)19克MgCl2的物质的量为:![]() =0.2mol,0.2mol氯化镁中含有0.2mol镁离子、0.4mol氯离子,总共含有0.6mol离子,含有离子数目0.6NA=0.6×6.02×1023=3.61×1023;
=0.2mol,0.2mol氯化镁中含有0.2mol镁离子、0.4mol氯离子,总共含有0.6mol离子,含有离子数目0.6NA=0.6×6.02×1023=3.61×1023;
(5)甲烷CH4原子数为5,氨气 NH3原子数为4,它们所含原子数相等,所以物质的量5x:4y=1:1,可知 x:y=4:5 ,质量比为(4×16):(5×17)=64:85。


科目:高中化学 来源: 题型:
【题目】下列关于元素的原子结构与元素性质的叙述正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.短周期元素形成离子后,最外层都达到8电子稳定结构
C.第三周期主族元素的最高正化合价等于它所处的主族序数
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是_________________。
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O | C=O | O-H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
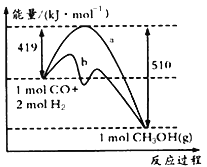
请回答下列问题:
①如图中曲线a到曲线b的措施是_______________。
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池正极的电极反应式为____________________。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为_____________。
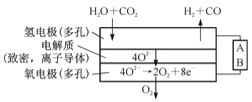
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(70-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由右图可知A为直流电源的 (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关LiFePO4的说法中正确的是( )
A.LiFePO4是共价化合物
B.LiFePO4中所有元素都属于短周期元素
C.LiFePO4中的四种元素中有三种元素属于主族元素
D.Li和O2反应可生成既含有离子键又含有非极性键的Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不具有放射性的同位素称为稳定同位素,如2H、13C、15N、18O、34S等,在陆地生态系统研究中常被用作环境分析指示物。下列说法中正确的是( )
A.18O原子核内的质子数为16
B.12C32S2比12C34S2更易挥发
C.13C和15N原子核内的质子数相差2
D.2H+的氧化性比1H+的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法正确的是
A.用量筒量取20.21 mL质量分数为98%的浓H2SO4
B.将5.85 g NaCl溶入100mL水中,制得1 mol/LNaCl溶液
C.将22.4 L HCl气体溶于水配成1 L且浓度为1 mol/L的盐酸
D.将1体积c mol/L的硫酸用水稀释为5体积,以获得浓度为0.2c mol/L的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A. 碱式滴定管未用待测液润洗 B. 滴定过程中不慎有液体溅出
C. 滴定前仰视读数,滴定后读数正确 D. 酸式滴定管未用标准盐酸润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com