
【题目】
A. C、H、N、P、Mn
B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo
D. N、P、K、Cu、Fe、I
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究过氧化氢的性质。回答下列问题:
(1)甲组同学拟配制5%的H2O2溶液,他们先从文献查得H2O2的稳定性与pH的关系如图所示。则配制H2O2溶液时应滴入几滴_____________(填“稀硫酸”或“氨水”)。

(2)乙组同学向一支试管中加入2mLFeCl2溶液,再滴入几滴甲组同学配制的H2O2溶液,最后滴人KSCN溶液,溶液变红,H2O2与Fe2+发生反应的离子方程式为_________________;另取一支试管,向其中加入SO2与BaCl2混合溶液2mL,再滴入几滴5%的H2O2溶液,现象是_____________。
(3)丙组同学取2mLKMnO4溶液于试管中,向其中滴几滴5%的H2O2溶液,发现溶液逐渐褪色,该反应中的还原剂是____________(填化学式)。
(4)丁组同学向一支试管中加入2mL5%的H2O2溶液、0.5mL乙醚、1mLlmol/LH2SO4溶液和3~4滴0.5mol/LK2Cr2O7溶液,发现上层乙醚层为蓝色(CrO5的乙醚溶液),一段时间后上层蓝色消失。

①乙醚的主要作用是____________。
②开始时,H2O2溶液与K2Cr2O7酸性溶液反应生成CrO5,该反应属于____________(填“氧化还原”或“非氧化还原”)反应。
③一段时间后,乙醚层中的CrO5与水相中的H+作用生成Cr3+并产生无色气泡,从而使蓝色逐渐消失,该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的量的有关公式计算(注:(2)(3)(4)计算结果保留小数点后两位)
(1)3.01×1023个NH4+,其质量为 g。
(2)欲配制1L 0.2 mol.L-1的盐酸溶液,需标准状况下HCl的体积为 L。
(3)现将50 mL密度为1.84 g/cm3,质量分数为98.0 %的浓硫酸,稀释至250 mL,则稀释后,溶液的物质的量浓度为 。
(4)19克MgCl2中含有离子数目 。
(5)所含原子数相等的甲烷和氨气(NH3)的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
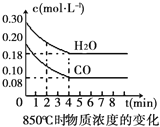
(1)0~4min的平均反应速率v(CO)=___________molL-1min-1.
(2)该条件下,此反应的平衡常数K=___________(写表达式).
(3)该反应平衡时CO的转化率为________________。
(4)能判断该反应达到化学平衡状态的依据是______________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
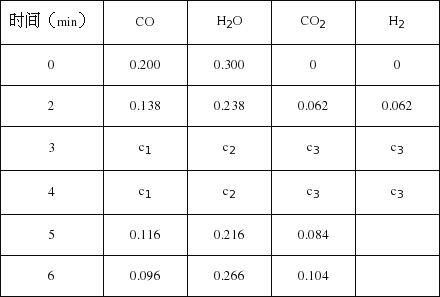
① c1数值___________0.08molL-1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________________,表中5min~6min之间数值发生变化,可能的原因是_______________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O42H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )
A. 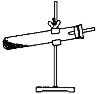 B.
B. ![]() C.
C. 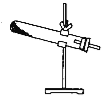 D.
D. 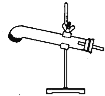
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
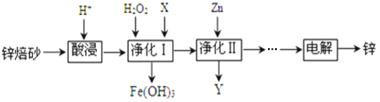
回答下列问题:
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
① ZnFe2O4中Fe的化合价是___________,从物质分类角度说,ZnFe2O4属于__________(填“酸”、“碱”或“盐”)。
② 工业上利用反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是___________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有______________。
(3)净化Ⅰ中H2O2参与反应的离子方程式为_______________;试剂X的作用是___________。
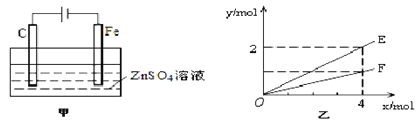
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。
① C电极的电极反应式为________________________。
② E可以表示的量是_________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是
A. 用10ml量筒量取7.13ml稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 中和滴定时用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
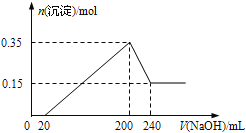
A.Mg和Al的总质量为8g B.硫酸的物质的量浓度为5mol/L
C.NaOH溶液的物质的量浓度为5mol/L D.生成的H2在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的Na2O
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.用碳酸钠和氢氧化钙反应制NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com