
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
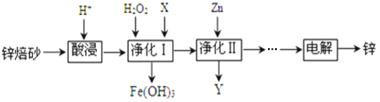
回答下列问题:
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
① ZnFe2O4中Fe的化合价是___________,从物质分类角度说,ZnFe2O4属于__________(填“酸”、“碱”或“盐”)。
② 工业上利用反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是______________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是___________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有______________。
(3)净化Ⅰ中H2O2参与反应的离子方程式为_______________;试剂X的作用是___________。
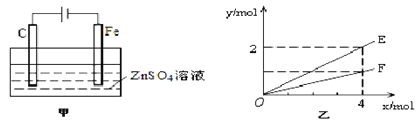
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。
① C电极的电极反应式为________________________。
② E可以表示的量是_________________________(任写一种)。
【答案】
(1)①+3;盐;②ZnFe2O4、CO2;4mol;
(2)增大硫酸的浓度(或升高温度、空气搅拌等);Zn2+、Fe3+、Fe2+、Cu2+;
(3)H2O2+2Fe2++2H+=2Fe3++2H2O;调节溶液的pH,促进Fe3+水解;
(4)①4OH--4e-=O2+2H2O;②消耗水的物质的量、生成硫酸的物质的量、生成Zn的物质的量等任写一种。
【解析】
试题分析:(1) ① 根据正负化合价的代数和为0,ZnFe2O4中Fe的化合价是+3,从物质分类角度说,ZnFe2O4属于盐,故答案为:+3;盐;
② 在反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O中铁元素的化合价由+2价升高到+3价,被氧化,碳元素的化合价由+3价变成+2价和+4价,氧化产物为ZnFe2O4和CO2,每生成1mol ZnFe2O4同时生成2mol二氧化碳,转移电子的物质的量为1mol ×(3-2)×2+2mol×(2-1)=4mol,故答案为:ZnFe2O4、CO2;4mol;
ZnFe2O4+2CO2↑+4CO↑+6H2O中铁元素的化合价由+2价升高到+3价,被氧化,碳元素的化合价由+3价变成+2价和+4价,氧化产物为ZnFe2O4和CO2,每生成1mol ZnFe2O4同时生成2mol二氧化碳,转移电子的物质的量为1mol ×(3-2)×2+2mol×(2-1)=4mol,故答案为:ZnFe2O4、CO2;4mol;
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,还可采用的措施有增大硫酸的浓度、升高温度、空气搅拌等;锌焙砂主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质,其中ZnFe2O4能溶于酸,ZnO、FeO、CuO也都能溶于酸,酸浸后溶液中存在的金属离子有Zn2+、Fe3+、Fe2+、Cu2+,故答案为:增大硫酸的浓度(或升高温度、空气搅拌等);Zn2+、Fe3+、Fe2+、Cu2+;
(3)净化Ⅰ中H2O2将亚铁离子氧化,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;试剂X可以调节溶液的pH,促进Fe3+水解,故答案为H2O2+2Fe2++2H+=2Fe3++2H2O;调节溶液的pH,促进Fe3+水解;
(4)由甲可知,为电解装置,C为阳极,发生4OH--4e-=O2↑+2H2O,铁为阴极,发生Zn2++2e-=Zn,总反应为2ZnSO4+2H2O![]() 2Zn+O2↑+2H2SO4,结合乙可知,转移4mol电子生成2molE,生成1molF,由电子与物质的物质的量的关系可知E表示反应生成铜的物质的量,由总反应可知,Cu与水的物质的量相同,则E表示反应消耗水的物质的量或生成硫酸的物质的量等,故答案为:①4OH--4e-=O2+2H2O;②消耗水的物质的量(或生成硫酸的物质的量、或生成Zn的物质的量)。
2Zn+O2↑+2H2SO4,结合乙可知,转移4mol电子生成2molE,生成1molF,由电子与物质的物质的量的关系可知E表示反应生成铜的物质的量,由总反应可知,Cu与水的物质的量相同,则E表示反应消耗水的物质的量或生成硫酸的物质的量等,故答案为:①4OH--4e-=O2+2H2O;②消耗水的物质的量(或生成硫酸的物质的量、或生成Zn的物质的量)。


科目:高中化学 来源: 题型:
【题目】(物质结构与性质)黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:
2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K____________(填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为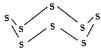 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为___________,,N2的沸点比CO的沸点__________(填“高”或“低”)。
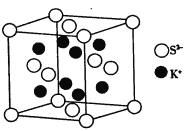
(5)K2S的晶胞结构如图所示。其中K+的配位数为_____________,S2-的配位数为__________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为__________g·cm-3(列出计算式,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不具有放射性的同位素称为稳定同位素,如2H、13C、15N、18O、34S等,在陆地生态系统研究中常被用作环境分析指示物。下列说法中正确的是( )
A.18O原子核内的质子数为16
B.12C32S2比12C34S2更易挥发
C.13C和15N原子核内的质子数相差2
D.2H+的氧化性比1H+的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物,则下列说法错误的是( )
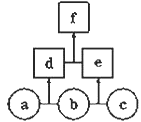
A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面对细胞中的元素和化合物的叙述错误的是
A. P、S、K、Ca是大量元素
B. Mn、Zn、Cu、Mo是微量元素
C. 含量最多的化合物是蛋白质
D. 组成生物体的元素及其化合物种类相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
成分的质量/g | 摩尔质量/(gmol-1) | |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________molL-1(要求:用原始数据写出表达式即可,不需要化简与计算)。
(2)配制上述“鲜花保鲜剂”所需的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、
____________________(填所缺仪器的名称)。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________(填字母).
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol·L-1500ml的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___________(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________,该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求写出下列反应的离子方程式
①人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用胃舒平【氢氧化铝】给病人治疗。该反应的离子方程式为___________________;
②实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式___________________;常用澄清石灰水检验CO2气体的离子方程式是___________________;
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是___________________;反应片刻后,可观察到有气体产生,其离子方程式是___________________;
(2)按要求将化学方程式改为离子方程式
2Na2O2 +2H2O =4NaOH +O2↑___________________;
(3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式___________________;
(4)有一瓶无色澄清溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
A、用PH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有 ;肯定不存在的离子有 ;
可能存在的离子有 。
②写出C中发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com